题目内容
【题目】几种短周期元素的原子半径及主要化合价如表:
元素代号 | X | Y | Z | W |
原子半径 | 160 | 143 | 70 | 66 |
主要化合价 |
|
|
|
|
下列叙述正确的是
A. X的电负性大于Y的电负性
B. W的氢化物比同族其它元素的氢化物稳定,是因为W的氢化物中存在氢键
C. Y的最高价氧化物对应的水化物能溶于稀硫酸和稀氨水
D. W的非金属性比Y强
【答案】D
【解析】
在主族元素中,元素的最高化合价与其族序数相等,原子的电子层数越多其原子半径越大,根据元素化合价可知,W元素的化合价是-2价,没有最高正化合价+6价,则W是O元素,Z元素化合价为+5,+3,-3,Z处于ⅤA族,原子半径与氧元素相差不大,则Z与氧元素处于同一周期,则Z为N元素,X的化合价为+2价,应为周期表第ⅡA族,Y的化合价为+3价,应为周期表第IIIA族,两者原子半径相差较小,可以知道两者位于同一周期相邻主族,因为X、Y的原子半径与W、Z的原子半径相差很大,则X、Y应在第三周期,所以X为Mg元素,Y为Al元素,据此答题。
A.一般来说,周期表从左到右,元素的电负性逐渐变大;周期表从上到下,元素的电负性逐渐变小,由推断可知Y为Al元素,X为Mg元素,所以电负性:Al>Mg,故A错误;
B.W为O元素,水比同族其他元素的氢化物稳定,是因为O的非金属性比同族其他元素的的非金属性强,与氢键无关,故B错误;
C.由推断可知Y为Al元素,Y的最高价氧化物对应的水化物为氢氧化铝,氢氧化铝为两性氢氧化物,可以与稀硫酸反应,但是与弱碱稀氨水不反应,故C错误;
D.由推断可知Y为Al元素,W为O元素,同一周期元素的非金属性逐渐增大,同一主族元素的非金属性逐渐减弱,所以非金属性O>Al,故D正确。
故选D。

 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案【题目】某实验小组利用下图所示装置在实验室欲制备乙酸乙酯。
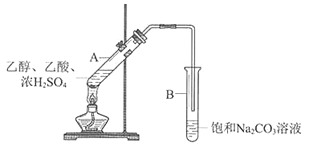
(1)B装置中,导管口略高于液面的目的是________________________
(2)为了改善反应过程中混合溶液变黑的现象,甲同学采用NaHSO4代替浓硫酸做催化剂(其他试剂及用量不变)来制备乙酸乙酯,NaHSO4可代替浓硫酸做催化剂的原因是__________________________________________________________
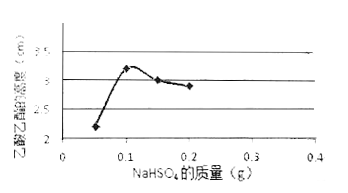
(3)下图是甲同学采用NaHSO4做催化剂,其他条件不变(其中乙酸用量为2 mL)不同质量的NaHSO4来制备乙酸乙酯的催化效果图,其中NaHSO4的质量为_______g时催化效果最好。
(4)乙同学实验时,在饱和NaCO3中滴加两滴酚酞,实验结束,取下试管B振荡,红色褪去。为探究褪色的原因,进行如下实验。
编号 | ① | ② | ③ |
实验 |
|
|
|
操作 | 充分振荡、静置 | 充分振荡、静置 | 充分振荡、静置、分液。取下层溶液,加入饱和Na2CO3溶液 |
现象 | 上层液体变薄,冒气泡,下层溶液红色褪去 | 上层液体不变薄,无气泡,下层溶液红色褪去 |
a试管①中产生气泡的原因是(用化学方程式解释)____________________________。
b对比实验①和②可得出的结论是___________________________________。
c针对实验②中现象,乙同学提出猜想:酚酞更易溶于乙酸乙酯。实验③中观察到__________________________________,证实乙的猜想正确。
【题目】已知X、Y是主族元素,I为电离能,单位是![]() 根据如表所列数据判断,错误的是
根据如表所列数据判断,错误的是
元素 |
|
|
|
|
X | 496 | 4562 | 6912 | 9543 |
Y | 578 | 1817 | 2745 | 11575 |
A. 元素X的常见化合价是![]() 价
价
B. 元素Y是ⅢA族元素
C. X单质的熔点高于Y单质的熔点
D. 若元素X处于第3周期,它的单质可与冷水剧烈反应