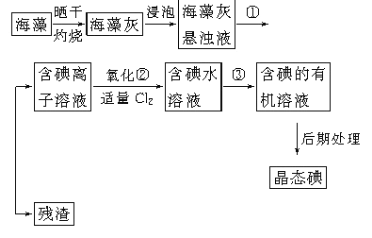
题目内容
【题目】科学家预言,燃料电池将是21世纪获得电能的重要途径。近几年开发的甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理的示意图如下:
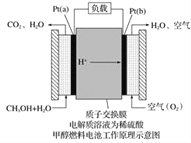
请回答下列问题:
(1)Pt(a)电极是电池的________极,电极反应式为__________________;Pt(b)电极发生________(填“氧化”或“还原”)反应,电极反应式为___________。
(2)电池的总反应方程式为____________________。
(3)如果该电池工作时电路中通过2 mol电子,则消耗的CH3OH有______mol。
【答案】 负 CH3OH+H2O-6e-===CO2+6H+ 还原 O2+4H++4e-===2H2O 2CH3OH+3O2===2CO2+4H2O ![]()
【解析】试题分析:(1)根据装置图可知Pt(a)电极通入甲醇被氧化为CO2,所以Pt(a)是负极,电极反应式为CH3OH-6e—=CO2+6H+;Pt(b)电极是正极,反生还原反应,氧气得到电子。电极反应式为O2+4H++4e—=2H2O。
(2)根据以上分析可知总反应式为甲醇被氧气氧化为CO2和水,方程式为2CH3OH+3O2=2CO2+4H2O。
(3)根据负极电极反应式CH3OH-6e—=CO2+6H+可知如果该电池工作时电路中通过2mol电子,则消耗的CH3OH有2mol÷6=1/3mol。

 教学练新同步练习系列答案
教学练新同步练习系列答案【题目】下列实验操作、实验现象和实验结论均正确的是
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 向一定浓度CuSO4溶液中通入H2S气体 | 出现黑色沉淀 | H2S酸性比H2SO4强 |
B | 常温下,相同铝片分别投入足量稀、浓硫酸中 | 浓硫酸中铝片先溶解完 | 反应物浓度越大,反应速率越大 |
C | 2mL0.1mol·L-1MgCl2溶液中滴加2滴1mol·L-1NaOH溶液,再滴加2滴0.1mol·L-1FeCl3溶液 | 先生成白色沉淀,后生成红褐色沉淀 | Ksp[Mg(OH)2]>|Ksp[Fe(OH)3] |
D | 向2mL2%CuSO4溶液中加入几滴1%NaOH溶液,振荡后加入几滴有机物Ⅹ溶液,加热 | 未出现砖红色沉淀 | Ⅹ不可能是葡萄糖 |
A. A B. B C. C D. D