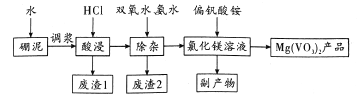
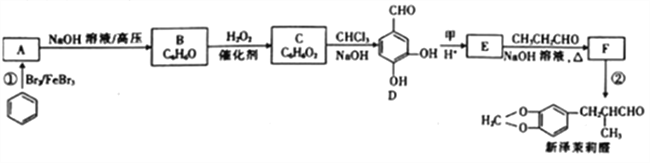
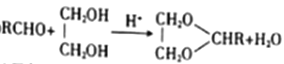
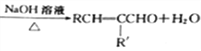题目内容
【题目】下列实验操作、实验现象和实验结论均正确的是
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 向一定浓度CuSO4溶液中通入H2S气体 | 出现黑色沉淀 | H2S酸性比H2SO4强 |
B | 常温下,相同铝片分别投入足量稀、浓硫酸中 | 浓硫酸中铝片先溶解完 | 反应物浓度越大,反应速率越大 |
C | 2mL0.1mol·L-1MgCl2溶液中滴加2滴1mol·L-1NaOH溶液,再滴加2滴0.1mol·L-1FeCl3溶液 | 先生成白色沉淀,后生成红褐色沉淀 | Ksp[Mg(OH)2]>|Ksp[Fe(OH)3] |
D | 向2mL2%CuSO4溶液中加入几滴1%NaOH溶液,振荡后加入几滴有机物Ⅹ溶液,加热 | 未出现砖红色沉淀 | Ⅹ不可能是葡萄糖 |
A. A B. B C. C D. D
【答案】C
【解析】A,向CuSO4溶液中通入H2S,发生反应的化学方程式为:CuSO4+H2S=CuS↓+H2SO4,H2S为弱酸,H2SO4为强酸,该反应发生的原因是:CuS不仅难溶于水而且难溶于酸,生成难溶的CuS使得离子浓度减小,A项错误;B,常温下铝与浓硫酸发生钝化,铝片在浓硫酸中不能溶解,B项错误;C,2mL0.1mol/LMgCl2溶液中滴加2滴1mol/LNaOH溶液,产生白色Mg(OH)2沉淀后MgCl2过量,再滴加2滴0.1mol/LFeCl3溶液,白色沉淀转化为红褐色Fe(OH)3沉淀,根据沉淀转化的一般原则,Ksp[Mg(OH)2]![]() Ksp[Fe(OH)3],C项正确;D,向2mL2%CuSO4溶液中加入几滴1%NaOH溶液,产生Cu(OH)2悬浊液且CuSO4溶液过量,加入X溶液,加热未出现砖红色沉淀,不能说明X中不含醛基,X可能是葡萄糖,D项错误;答案选C。
Ksp[Fe(OH)3],C项正确;D,向2mL2%CuSO4溶液中加入几滴1%NaOH溶液,产生Cu(OH)2悬浊液且CuSO4溶液过量,加入X溶液,加热未出现砖红色沉淀,不能说明X中不含醛基,X可能是葡萄糖,D项错误;答案选C。

练习册系列答案
相关题目