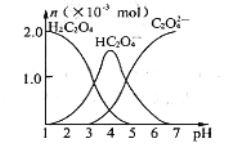
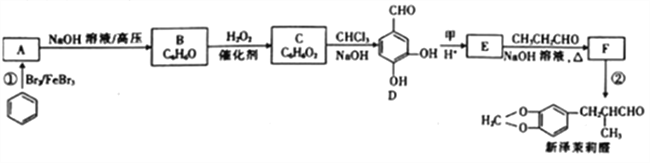
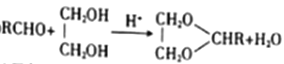
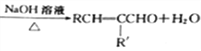��Ŀ����
����Ŀ��ʵ�鷨��ѧϰ��ѧ����Ҫ������
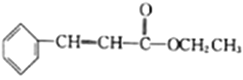
�������к��зḻ�ĵ�Ԫ�أ��Ե����ӵ���ʽ���ڡ�ʵ������Ӻ�������ȡ�����������(��֪2I-��Cl2=2Cl-��I2��������һ���������л��ܼ�)��
��1��ʵ������ٵ����ƣ�___________________ ��
��2��ʵ�鲽����м�����Cl2��Ŀ����______________________________��
��3��ʵ�鲽�����ȡ��Ĺ����У�����ѡ�õ��ܼ���________��
A���� B���ƾ� C�����Ȼ�̼
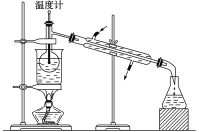
��4���Ӻ��忪ʼ����5��������������л���Һ��ʵ���������Ҫ�õ�����ʵ����������֪ʵ������������������ǯ���ձ������������ƾ��ơ�ʯ�������Լ���Ҫ�ļг���������Ʒ����ȱ�ٵIJ���������__________________��________________��
��5���Ӻ�����л���Һ����ȡ��ͻ����л��ܼ������辭������ָ����ͼ��ʾʵ��װ���еĴ���֮����_________________��_________________��__________________��
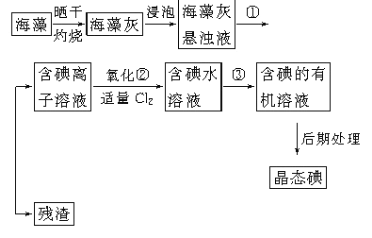
��ijѧ�����������ʵ�鷽������NaCl��CaCl2���ֹ�������:
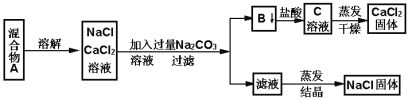
��պͻش���������
��1��д������B���ʵĻ�ѧ����ʽ________________
��2����Һ�е�������_____________________��д��ѧʽ������Ҫ�Ƶô�����NaCl��Ӧ����Һ�м���������ij���Լ������Լ���������_________________ ��
��3����Ҫ�ⶨ����Ʒ��NaCl��CaCl2�������ȣ��ɳ��������B���ʺ���һ���ʵ�����������������___________________________��
���𰸡����� ��I- ת��ΪI2 B ��Һ©�� ©�� ��ʯ���� �¶ȼ�ˮ�����λ�ò��� ˮ�������Ͻ��³� CaCl2+Na2CO3=CaCO3+2NaCl NaCl�� Na2CO3 ���� �����A
��������
����1��������ҵ�����Һ���й��˺�õ����е����ӵ���Һ��ʵ������ٵ����ƣ��������������������������������
��2�������ӱ�Ϊ�ⵥ������Ҫ���������������ʵ�鲽����м�����Cl2��Ŀ���ǽ�I- ת��ΪI2 ������������������ǣ���I- ת��ΪI2 ��
��3����ȡ��Ĺ�����Ϊ��ȡ,��ȡ��ѡ��ԭ��:����ԭ��Һ�е��ܼ���������; �������ʵ��ܽ��ҪԶ����ԭ�ܼ���
A.����ˮ��������,���ڱ����ܽ��ԶԶ����ˮ��,��Aѡ��
B.�ƾ���ˮ����,������ȡ��ˮ�еĵ�, ��Bѡ��
C.���Ȼ�̼��ˮ��������,�������Ȼ�̼���ܽ��ԶԶ����ˮ��,��C��ѡ��
��ˣ�������ȷ����:B��
��4���������Ϊ���������Ҫ�����������õ���������������������ǯ��ʯ��������������ҵ�����Һ���й�������Ҫ�õ����������ձ���©�������������ȡ�ͷ�Һ����Ҫ�����У���������������������Һ©�����ۺ������������Ӻ��忪ʼ����5��������������л���Һ��ʵ�����������ȱ�ٵIJ�������������Һ©����©�������������������������Һ©����©����
��5��)�ձ�����Ҫ��ʯ����,�����������������ˮ���Ͻ��³�,����ˮ�ķ������,ӦΪ�½��ϳ����¶ȼ�ˮ�����λ�ô������¶ȼ�ˮ����Ӧ����ƿ֧�ܿ���ƽ������������������ǣ���ʯ������ �¶ȼ�ˮ�����λ�ò��ԣ�ˮ�������Ͻ��³���
��(1)B�������Ȼ��ƺ�̼���Ʒ�Ӧ���ɵģ��Ҳ�����ˮ,�ɸ��ֽⷴӦ����֪��BΪ̼���,��Ӧ�ķ���ʽ��CaCl2+Na2CO3=CaCO3+2NaCl���������������������CaCl2+Na2CO3=CaCO3+2NaCl��
(2) ����ʵ�鷽������õ���NaCl,������������,ԭ����ǰ������̼���ƹ���, û�г�ȥ,������Һ�к���NaCl��Na2CO3���ʣ���Ҫ�Ƶô�����NaCl������Ҫ��ȥ̼���ƣ����ֲ�����������־�����Ӧ����Һ�м���������������Һ������������������ǣ�NaCl��Na2CO3�����ᡣ
(3)��Ҫ�ⶨ����Ʒ��NaCl��CaCl2�������ȣ��ɳ��������B���ʺ�A����������������ˣ�������ȷ����: �����A��