题目内容
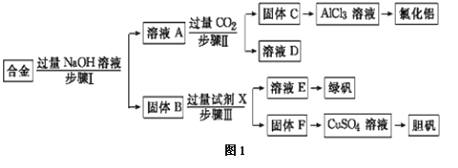
【题目】硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2:约45%,Fe2O3:约40%,Al2O3:约10%,MgO:约5%。目前我国已经在技术上取得突破――用硫酸渣炼铁。Fe3+开始沉淀为氢氧化物的pH=1,沉淀完全时的pH为3.7。某学生探究性学习小组的同学设计了不同的方案,用化学基本知识进行金属元素的提取实验。
方案一:

请回答:
(1)写出固体E的化学式:__________________。试剂①是_______
A.氢氧化钠 B.氧化铝 C.氨水 D.水
(2)若要准确测定溶液的pH是否达到3.7,下列物品中可供使用的是_________
A.石蕊试液 B.广泛pH试纸 C.pH计
(3)溶液H中溶质的化学式:__________________
(4)要将固体C、固体E和固体G都转化为相应的稳定的氧化物,需进行的实验操作为 。
方案二:

(5)此方案制得的氧化铝含有的主要杂质是:_______________
(6)写出由溶液M固体乙这个过程中,主要化学反应的离子方程式:
_____________________;___________________
【答案】(1)Mg(OH)2 ;A;
(2)C;
(3)NaCl、NaHCO3 ;
(4)灼烧(或加热) ;
(5)二氧化硅;
(6) AlO2- +CO2+2H2O=Al(OH)3 + HCO3-、SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-
【解析】
试题分析:根据硫酸渣的成分为SiO2、Fe2O3、Al2O3、MgO,当向硫酸渣中加过量盐酸时,二氧化硅和盐酸不反应,所以固体A是二氧化硅,氧化铁、氧化铝、氧化镁和盐酸反应,所以溶液B的溶质是氯化镁、氯化铁、氯化铝、盐酸(过量);向溶液B中加试剂①并调节溶液的pH值为3.7,结合题意溶液pH=3.7时Fe3+已经沉淀完全知,试剂①是能和氯化铁反应生成沉淀的物质且和铝离子反应没有沉淀生成,所以试剂①只能是强碱溶液,固体C是氢氧化铁;向溶液D中加入试剂①并调节溶液的pH值为13,溶液呈强碱性溶液,铝元素在溶液中以偏铝酸根离子存在,镁离子和氢氧根离子生成氢氧化镁沉淀,所以固体E是氢氧化镁;溶液F的溶质含有偏铝酸钠和氯化钠,向F溶液中通入过量二氧化碳气体,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀,所以G是氢氧化铝。
(1)固体E是氢氧化镁,试剂①是强碱溶液,故选A;故答案为:Mg(OH)2;A;
(2)因pH值精确到小数点后一位,而石蕊试液测得的pH值在一个范围内,广泛pH试纸测得的pH值是一个整数,精密pH试纸、pH计均可准确到小数点后一位,故选:C;
(3)溶液F的溶质含有偏铝酸钠和氯化钠,向F溶液中通入过量二氧化碳气体,偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,故答案为:NaCl、NaHCO3;
(4)固体C是氢氧化铁,固体E是氢氧化镁,固体G是氢氧化铝,加热均可分解得到对应的氧化物,故答案为:灼烧;
(5)产品不纯,最后产物中含有大量的二氧化硅,故答案为:二氧化硅;
(6)溶液主要含有硅酸钠和偏铝酸钠,硅酸钠和二氧化碳反应生成硅酸沉淀和碳酸氢钠,方程式为:Na2SiO3+2CO2+2H2O=H2SiO3↓+2NaHCO3,偏铝酸钠与二氧化碳反应生成氢氧化铝沉淀,反应的离子方程式为AlO2- +CO2+2H2O=Al(OH)3 + HCO3-,故答案为:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO32-;AlO2- +CO2+2H2O=Al(OH)3 + HCO3-。

 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案