题目内容
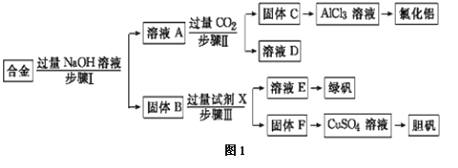
【题目】某工厂的废金属屑的主要成分为铝、铁和铜,某化学兴趣小组在学习了元素及其化合物的相关知识后,设计了如图1实验流程,用该工厂的金属废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O)。
请回答:
(1)写出步骤Ⅱ反应的离子方程式: 。
(2)步骤Ⅰ、Ⅱ、Ⅲ进行的实验操作中均需用到的玻璃仪器有 。
(3)进行步骤Ⅱ时,该小组用如图2所示装置及试剂制取CO2并将制得的气体通入溶液A中一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少,原因是 。
(4)从溶液E得到绿矾晶体的实验操作是 。
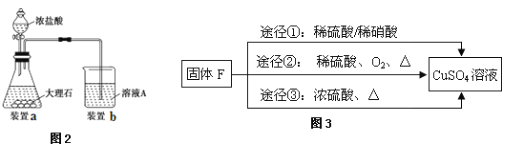
(5)用固体F制备CuSO4溶液,可设计如图3三种途径:
写出途径③中反应的化学方程式: ,用途径①制备CuSO4溶液时,混酸中硫酸和硝酸的最佳物质的量之比为 。
(6)用惰性电极电解硫酸铜溶液一段时间后,阴极增重3.2g。请写出阳极电极反应式 ,阳极产生 L气体(标准状况)。
【答案】
(1)AlO2-+ CO2 + 2H2O =Al(OH)3↓ + HCO3-、CO2 +OH-=HCO3-
(2)烧杯、玻璃棒、漏斗
(3)由装置a制取的CO2中含HCl气体,通入溶液A中会溶解Al(OH)3
(4)蒸发浓缩、冷却结晶、过滤
(5)Cu + 2H2SO4(浓) ![]() CuSO4 + SO2↑+ 2H2O;3:2
CuSO4 + SO2↑+ 2H2O;3:2
(6)2H2O - 4e- =O2↑+ 4H+ 或4OH- - 4e- =O2↑+ 2H2O;0.56
【解析】
试题分析:铝、铁和铜的合金中只有金属铝可以和氢氧化钠反应,过滤后,得到溶液A含有NaAlO2,固体B为Cu和Fe.溶液A中通入过量的二氧化碳可以得到氢氧化铝沉淀与碳酸氢钠,过滤分离,得到C为Al(OH)3,D为NaHCO3溶液,C和碳酸氢钠溶液D.固体B用试剂X反应,过滤分离得到溶液E,溶液E蒸发浓缩、冷却结晶可以获得绿矾晶体,可知试剂X为稀硫酸,E为FeSO4,F为Cu,Cu转化得到硫酸铜,CuSO4溶液蒸发浓缩、冷却结晶可以获得胆矾晶体。
(1)步骤Ⅱ中偏铝酸钠与二氧化碳反应生成氢氧化铝沉淀,反应离子方程式为:AlO2-+ CO2 + 2H2O =Al(OH)3↓ + HCO3-,故答案为:AlO2-+ CO2 + 2H2O =Al(OH)3↓ + HCO3-;
(2)步骤Ⅰ、Ⅱ、Ⅲ均是固体和液体的分离操作,应该是过滤,需用到的玻璃仪器有烧杯、玻璃棒、漏斗,故答案为:烧杯、玻璃棒、漏斗;
(3)盐酸具有挥发性,挥发出的HCl导致氢氧化铝溶解,故答案为:由装置a制取的CO2中含HCl气体,通入溶液A中会溶解Al(OH)3;
(4)从硫酸铜溶液中获得晶体,需要经过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等操作,故答案为:蒸发浓缩;冷却结晶;过滤;
(5)途径③中Cu与浓硫酸反应生成硫酸铜、二氧化硫与水,反应化学方程式为Cu + 2H2SO4(浓) ![]() CuSO4 + SO2↑+ 2H2O,途径①中Cu与混酸反应生成铜盐、NO与水,反应离子方程式为:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,根据离子方程式,可知混酸中硫酸和硝酸的最佳物质的量之比
CuSO4 + SO2↑+ 2H2O,途径①中Cu与混酸反应生成铜盐、NO与水,反应离子方程式为:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,根据离子方程式,可知混酸中硫酸和硝酸的最佳物质的量之比![]() :2=3:2,故答案为: Cu + 2H2SO4(浓)
:2=3:2,故答案为: Cu + 2H2SO4(浓) ![]() CuSO4 + SO2↑+ 2H2O;3:2
CuSO4 + SO2↑+ 2H2O;3:2
(6) 用铂电极电解CuSO4溶液,阴极电极反应:Cu2++2e-=Cu,阳极电极反应:4OH--4e-=2H2O+O2↑,当阴极产生3.2g即0.05mol铜时,转移电子是0.1mol,此时阳极上产生氧气的物质的量是0.025mol,即标准状况下体积是0.56L,故答案为:2H2O - 4e- =O2↑+ 4H+ 或4OH- - 4e- =O2↑+ 2H2O;0.56。

【题目】以下为三种有机物的有关信息,根据表中信息回答问题.
A | B | C |
其产量用来衡量一个国家的石油化工水平. | 比例模型为:
| 沼气主要成分 |
(1)A结构简式是_____________。该物质能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色。其中,与高锰酸钾溶发生的反应是_______________(填反应类型);与溴反应的化学方程式为_____________,当溴的四氯化碳溶液质量增加2.8g时,生成物的质量为__________。
(2)工业上,B来源于煤干馏后的液态产物煤焦油.B与浓硝酸发生取代反应,该反应的化学方程式为__________。
(3)C与氯气反应能生成二氯代物,请写出该反应的化学方程式为__________。