题目内容
15.设nA为阿伏加德罗常数,下列说法正确的是( )| A. | 常温下,28g C2H4含nA个碳碳双键 | |
| B. | 1mol丙烯酸中含有双键的数目为NA | |
| C. | 常温常压下,22.4L CCl4含有nA个CCl4分子 | |
| D. | 100ml0.1mol/L的醋酸溶液中含有的氢离子数为0.01NA |
分析 A、求出乙烯的物质的量,然后根据1mol乙烯中含1mol碳碳双键来分析;
B、丙烯酸中含1条碳碳双键和1条碳氧双键;
C、常温常压下,四氯化碳为液态;
D、醋酸为弱酸.
解答 解:A、28g乙烯的物质的量为1mol,而1mol乙烯中含1mol碳碳双键,故含nA个,故A正确;
B、丙烯酸中含1条碳碳双键和1条碳氧双键,故1mol丙烯酸中含2mol双键即2nA个,故B错误;
C、常温常压下,四氯化碳为液态,不能计算出四氯化碳的物质的量,故C错误;
D、醋酸为弱酸,不能完全电离,故溶液中的氢离子的个数小于0.01nA,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
6.为精确测定工业纯碱中碳酸钠的质量分数(含少量NaCl),准确称量W0g样品进行实验,下列实验方法所对应的实验方案和测量数据最合理(除W0外)的是( )
| 实验方法 | 实验方案 | 测量数据 | |
| A | 滴定法 | 将样品配成100 mL溶液,取10 mL,加入甲基橙,用 标准盐酸滴定 | 消耗盐酸的体积 |
| B | 量气法 | 将样品与盐酸反应,生成的气体全部被碱石灰吸收 | 碱石灰增重 |
| C | 重量法 | 样品放入烧瓶中,置于天平上,加入足量盐酸 | 减轻的质量 |
| D | 量气法 | 将样品与盐酸反应,气体通过排水量气装置量气 | 排水体积 |
| A. | A | B. | B | C. | C | D. | D |
3.水是( )
①单质;②混合物;③化合物;④纯净物;⑤氧化物.
①单质;②混合物;③化合物;④纯净物;⑤氧化物.
| A. | ①②③ | B. | ③④⑤ | C. | ①③⑤ | D. | ②③④⑤ |
7.某二元酸(H2A)在水中的电离方程式为H2A═H++HA-,HA-?H++A2-(25℃时,Ka=1.0×10-2),下列有关说法中正确的是( )
| A. | H2A是弱酸 | |
| B. | 稀释0.1mol/L H2A溶液,因电离平衡向右移动而导致c(H+)增大 | |
| C. | 在0.1mol/L的H2A溶液中,c(H+)=0.12mol/L | |
| D. | 若0.1mol/L的NaHA溶液中c(H+)=0.02mol/L,则0.1mol/L的H2A溶液中c(H+)<0.12mol/L |
19.在标准状况下,把收集满NO2气体的集气瓶倒置在氢氧化钠溶液中,最后得到的结果是( )
| A. | NO2体积不变 | B. | 剩余三分之一体积一氧化氮气体 | ||
| C. | 溶液充满集气瓶 | D. | 二氧化氮和一氧化氮 |
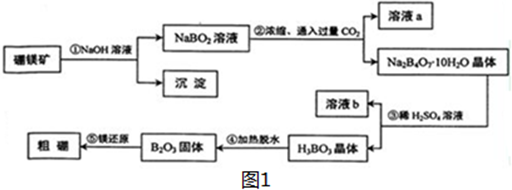
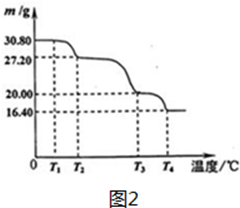

 ,E的电子式
,E的电子式 ,y的结构式H-Cl;
,y的结构式H-Cl; ;反应②的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2反应⑤的离子方程式为2Fe3++Fe=3Fe2+
;反应②的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2反应⑤的离子方程式为2Fe3++Fe=3Fe2+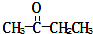 )、丙酸(CH3CH2COOH)和丁二酸(HOOCCH2CH2COOH),试推测此烃的构造式.
)、丙酸(CH3CH2COOH)和丁二酸(HOOCCH2CH2COOH),试推测此烃的构造式.