题目内容
20.如图为中学化学中几种常见物质的转化关系(部分产物已略去).已知:A.C是气体单质,B为金属;气体E极易溶于水、溶液能使紫色石蕊溶液变蓝.D为黑色固体,H的固体受热分解生成两种气体E和y,y的组成元素均为短周期元素.
(1)写出:G的化学式FeCl2,A的电子式
 ,E的电子式
,E的电子式 ,y的结构式H-Cl;
,y的结构式H-Cl;(2)x的形成过程:
 ;反应②的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2反应⑤的离子方程式为2Fe3++Fe=3Fe2+
;反应②的化学方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2反应⑤的离子方程式为2Fe3++Fe=3Fe2+(3)鉴定H中阳离子的实验方法和现象:取少许样品于试管中,加入NaOH溶液,加热,若产生能使红色石蕊试纸变蓝的气体则证明有NH4+.
分析 气体E极易溶于水、溶液能使紫色石蕊溶液变蓝,则E是氨气,A、C是气体单质,所以A和C中一种是氢气,一种是氮气,B是金属,B和X反应生成C和D,D为黑色固体,铁和水蒸气反应生成氢气和四氧化三铁,则C是氢气,A是氮气,B是铁,X是水,D是四氧化三铁,D和y反应生成F和G,F和氨气反应生成H和I,F和铁反应生成G,则y是酸、F是铁盐,G是亚铁盐,H的固体受热分解生成两种气体氨气和y,则H是铵盐,y的组成元素均为短周期元素,则y是氯化氢,F是氯化铁,G是氯化亚铁,H是氯化铵,I是红褐色沉淀,所以I是氢氧化铁,据此答题.
解答 解:气体E极易溶于水、溶液能使紫色石蕊溶液变蓝,则E是氨气,A、C是气体单质,所以A和C中一种是氢气,一种是氮气,B是金属,B和X反应生成C和D,D为黑色固体,铁和水蒸气反应生成氢气和四氧化三铁,则C是氢气,A是氮气,B是铁,X是水,D是四氧化三铁,D和y反应生成F和G,F和氨气反应生成H和I,F和铁反应生成G,则y是酸、F是铁盐,G是亚铁盐,H的固体受热分解生成两种气体氨气和y,则H是铵盐,y的组成元素均为短周期元素,则y是氯化氢,F是氯化铁,G是氯化亚铁,H是氯化铵,I是红褐色沉淀,所以I是氢氧化铁,
(1)根据上面的分析,G是氯化亚铁,G的化学式为 FeCl2,A是氮气,A的电子式为 ,E是氨气,E的电子式为
,E是氨气,E的电子式为 ,y是氯化氢,y的结构式为H-Cl,
,y是氯化氢,y的结构式为H-Cl,
故答案为:FeCl2; ;
; ;H-Cl;
;H-Cl;
(2)X是水,用电子式表示x的形成过程为: ;反应②的化学方程式为 3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;反应⑤的离子方程式为 2Fe3++Fe=3Fe2+,
;反应②的化学方程式为 3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;反应⑤的离子方程式为 2Fe3++Fe=3Fe2+,
故答案为: ;3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;2Fe3++Fe=3Fe2+;
;3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;2Fe3++Fe=3Fe2+;
(3)H为NH4Cl,阳离子为NH4+,取少量氯化铵的溶液加入试管中,用胶头滴管加入少量NaOH浓溶液,加热用湿润的红色石蕊试纸在试管口检验放出的气体,试纸变蓝色,证明含铵根离子;
故答案为:取少许样品于试管中,加入NaOH溶液,加热,若产生能使红色石蕊试纸变蓝的气体则证明有NH4+.
点评 本题考查无机框图的推断,较好的训练了学生对元素及化合物知识的应用以及推理问题的能力,该题的推断突破口是F的性质以及反应②,明确突破口是解答本题的关键.

| A. | 用5mL量筒准确量取4.55mL水 | |
| B. | 用分析天平准确地称取6.82g食盐 | |
| C. | 过滤时用玻璃棒搅拌漏斗内的液体,以加速过滤 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
| A. | S$\stackrel{O_{2}/点燃}{→}$SO3$\stackrel{H_{2}O}{→}$H2SO4 | |
| B. | 饱和NaCl(aq)$\stackrel{NH_{3},CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| C. | Fe2O3$\stackrel{HCl(aq)}{→}$FeCl3(aq)$\stackrel{△}{→}$无水FeCl3 | |
| D. | MgCl2(aq)$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{煅烧}{→}$MgO |
| A. | 铅蓄电池 | B. | 锂离子电池 | C. | 锌锰电池 | D. | 镍镉电池 |
| A. | 常温下,28g C2H4含nA个碳碳双键 | |
| B. | 1mol丙烯酸中含有双键的数目为NA | |
| C. | 常温常压下,22.4L CCl4含有nA个CCl4分子 | |
| D. | 100ml0.1mol/L的醋酸溶液中含有的氢离子数为0.01NA |
| A. | 60g丙醇中存在的共价键总数为10NA | |
| B. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| C. | 1L0.1mol/L的NaHCO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| D. | 235g核素${\;}_{92}^{235}$U发生裂变反应:${\;}_{92}^{235}$U+${\;}_{0}^{1}$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$U+10${\;}_{0}^{1}$n净产生的中子(${\;}_{0}^{1}$n)数为10NA |
| A. | 该反应中NH4NO3只作氧化剂 | |
| B. | 每还原1mol NO3-,需氧化1mol Zn和1mol NH4+ | |
| C. | 生成的烟中含有ZnO和NH4NO3 | |
| D. | 生成的白烟是N2溶于水形成的小液滴 |
反应:CH3CH2OH+HBr $\stackrel{△}{→}$ CH3CH2Br+H2O
装置:
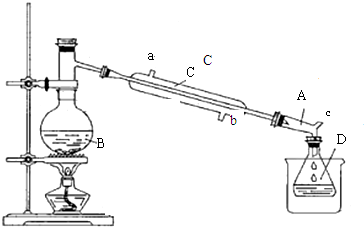
实验中可能用到的数据如下表:
| 物 质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3) | 水溶性 |
| CH3CH2OH | 46 | 78.4 | 0.79 | 互溶 |
| CH3CH2Br | 109 | 38.4 | 1.42 | 难溶 |
| CH3CH2OCH2CH3 | 74 | 34.5 | 0.71 | 微溶 |
| CH2=CH2 | 28 | -103.7 | 0.38 | 不溶 |
| 浓硫酸(H2SO4) | 98 | 338.0 | 1.38 | 易溶 |
②分离提纯:将馏出物加水后振荡,再加入适量酸除去乙醚,分液,最后得到52mL溴乙烷.
回答下列问题:
(1)加入试剂前一般在B中加少量碎瓷片,目的是防止瀑沸.
(2)仪器B的名称是蒸馏烧瓶.
(3)仪器C为直形冷凝管,冷水进口是b(填“a”或“b”).
(4)仪器D置于盛有冰水混合物的烧杯中,目的是冷却溴乙烷.
(5)溴乙烷粗产品可能混有多种杂质,在②分离提纯阶段,加水的目的是为了除除去溶解在溴乙烷中乙醇.
(6)该实验所得溴乙烷的产率为79%.(保留两位有效数值)
