题目内容
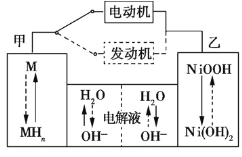
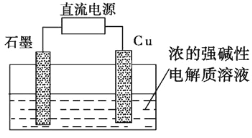
【题目】金属镍在电池和电镀等工业上具有广泛的用途,可镍也具有很强的毒性,若不进行回收处理,将对环境造成很大的影响,以下是以电镀废渣为原料获得NiSO46H2O的过程,已知,废渣中除含金属镍外,主要含有:Cu、Zn、Fe、Mg等元素的化合物。
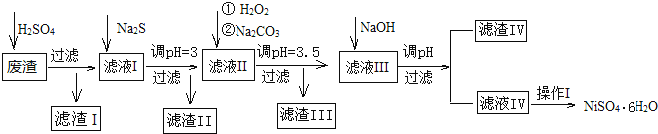
部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见表.
沉淀物 | Fe(OH)3 | Fe(OH)2 | CuS | ZnS | FeS | NiS | Al(OH)3 | Mg(OH)2 | Ni(OH)2 |
pH | 3.2 | 9.7 | ≥-0.42 | ≥2.5 | ≥7 | ≥7.5 | ≥5 | ≥8 | ≥8.5 |
(1)往废渣中加H2SO4酸浸,提高酸浸效率的方法有__(至少写出2点)。
(2)加Na2S同时调溶液的pH为3,目的是除去铜、锌等杂质,则往滤液Ⅱ中加入H2O2的反应的离子方程式为___。
(3)操作Ⅰ包括以下过程:__、__、过滤、洗涤、干燥.该洗涤过程不能用水洗涤,应该用__洗涤,目的是___。干燥有低温干燥和高温干燥,能否用高温干燥___,理由是____。
(4)滤液Ⅲ中加入NaOH溶液的目的是调节溶液的pH为8以除去Al3+以及少量的Mg2+,若向含有Mg2+、Al3+的溶液中滴加NaOH溶液,常温下当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Al3+)=__。{已知:25℃时,Ksp[Mg(OH)2]=5.0×10-14;Ksp[Al(OH)3]=2.0×10-33}。
【答案】搅拌、升温、适当增加硫酸浓度、废渣粉碎等 2Fe2++H2O2+2H+=2Fe3++2H2O 冷却 结晶 酒精 既能洗涤沉淀表面残余的溶液又有利晶体的干燥并减少NiSO4﹒6H2O晶体的损失 否 温度过高会使NiSO4﹒6H2O晶体失去部分或全部结晶水 2.5×1013
【解析】
根据流程图:废渣(除含镍外,还含有Cu、Zn、Fe、Mg等元素的化合物杂质),在硫酸溶解后过滤,除去不溶于硫酸的杂质铜等,滤液含有二价铁离子、铜离子、锌离子、镁离子等杂质,加入硫化钠调节pH=3,根据表格信息可除去铜离子、锌离子,然后加H2O2是将二价铁氧化成三价铁,再通过调节pH值3.5使三价铁以氢氧化物的沉淀而除去,滤液Ⅲ加入NaOH溶液的目的是调节溶液的pH为8以除去Al3+以及少量的Mg2+,滤液Ⅳ含有可溶性硫酸盐,为Na2SO4、NiSO4,经冷却结晶、过滤、洗涤,干燥得NiSO4﹒6H2O。
(1)根据影响反应速率的因素,搅拌、升温、适当增加硫酸浓度、废渣粉碎等,都可加快反应速率,所以提高酸浸效率的方法有:搅拌、升温、适当增加硫酸浓度、废渣粉碎等;
(2)滤液Ⅱ中加入H2O2的目的是将二价铁氧化成三价铁,再通过调节pH值3.5使三价铁以氢氧化物的沉淀而除去,反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)从溶液中得到晶体,可经过溶解、蒸发浓缩、冷却结晶、过滤、洗涤等操作,NiSO4﹒6H2O晶体易溶于水,洗涤过程不能用水洗涤,应用酒精洗涤,既能洗涤沉淀表面残余的溶液又有利晶体的干燥并减少NiSO4﹒6H2O晶体的损失;干燥应低温干燥,因温度过高会使NiSO4﹒6H2O晶体失去部分或全部结晶水。
(4)当两种沉淀共存且溶液的pH=8时,c(H+)=10-8mol/L, c(OH-)=10-6mol/L,根据25℃时,Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-)=5.0×10-14,可计算出c(Mg2+)=![]() =5.0×10-2mol/L;Ksp[Al(OH)3]=c(Al3+)×c3(OH-)=2.0×10-33,可计算出c(Al3+)=
=5.0×10-2mol/L;Ksp[Al(OH)3]=c(Al3+)×c3(OH-)=2.0×10-33,可计算出c(Al3+)=![]() =2.0×10-15mol/L,所以c(Mg2+):c(Al3+)=2.5×1013。
=2.0×10-15mol/L,所以c(Mg2+):c(Al3+)=2.5×1013。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案