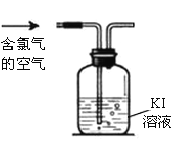
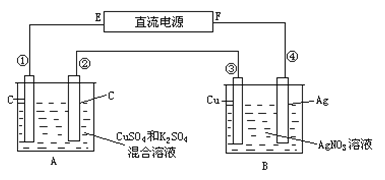
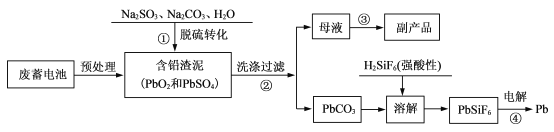
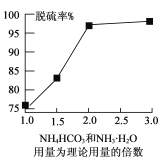
题目内容
【题目】实验室制备氨基甲酸铵(NH2COONH4)的反应如下:2NH3(g)+CO2(g)![]() NH2COONH4(s)该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢氨。
NH2COONH4(s)该反应在干燥条件下仅生成氨基甲酸铵,若有水存在则生成碳酸铵或碳酸氢氨。
(1)该反应在一定条件下能够白发进行,则反应的△H_____________0(填“>”、“<”或“一”)。
(2)写出生成碳酸氢氨的化学方程式:______________。
(3)实验步骤如下:
步骤1:按图所示组装仪器,检查装置的气密性。

步骤2:在相应仪器中装入药品,其中在三颈烧瓶中加入氢氧化钠固体,恒压滴液漏斗中装入浓氨水。
步骤3:滴加浓氨水并搅拌,调节反应速率,在反应器中得到产品。
干燥管中盛放的药品是___________。
对比碳酸盐和酸反应制CO2,该实验利用干冰升华产生CO2气体的优点是__________________。
③以恒压滴液漏斗代替分液漏斗的目的是______________________。
(4)该实验装置可能存在的安全问题是__________________。
【答案】(1)<;(2)NH3+CO2+H2O=NH4HCO3;(3)①碱石灰;②无水无需干燥(或其他合理答案);③使氨水顺利滴下;(4)产品易堵导管;稀硫酸可能倒吸(或其他合理答案)(每空2分)
【解析】
试题分析:(1)根据方程式2NH3(g)+CO2(g) ![]() NH2COONH4(s)可知,该反应是熵值减小的可逆反应。如果该反应在一定条件下能够自发进行,则根据△G=△H-T·△S可知,该的焓变ΔH一定小于0。(2)有水参加,则生成碳酸氢铵,因此反应的化学方程式为NH3+CO2+H2O=NH4HCO3。(3)①由于制备氨基甲酸铵的原料氨气必须是干燥的,以防止副反应的发生,因此生成的氨气必须进行干燥。因为氨气是碱性气体,所以干燥氨气应该用固体氢氧化钠或碱石灰。②碳酸盐和酸反应制CO2,则生成的CO2必须进行净化和干燥处理,而直接利用干冰制备CO2,不需要干燥;又因为该反应是放热反应,提供低温环境,可以提高转化率。③恒压滴液漏斗代替分液漏斗可以平衡内外压强,使氨水顺利滴下。④反应后期随着CO2气流减慢,导致反应物比例不当,此时可以通过调节恒压滴液漏斗旋塞,减慢氨水滴加速度加以控制。(4)由于氨基甲酸铵是固体,所以产品易堵塞导管。又因为氨气极易溶于水,直接插入稀硫酸中吸收氨气,容易使稀硫酸倒吸。
NH2COONH4(s)可知,该反应是熵值减小的可逆反应。如果该反应在一定条件下能够自发进行,则根据△G=△H-T·△S可知,该的焓变ΔH一定小于0。(2)有水参加,则生成碳酸氢铵,因此反应的化学方程式为NH3+CO2+H2O=NH4HCO3。(3)①由于制备氨基甲酸铵的原料氨气必须是干燥的,以防止副反应的发生,因此生成的氨气必须进行干燥。因为氨气是碱性气体,所以干燥氨气应该用固体氢氧化钠或碱石灰。②碳酸盐和酸反应制CO2,则生成的CO2必须进行净化和干燥处理,而直接利用干冰制备CO2,不需要干燥;又因为该反应是放热反应,提供低温环境,可以提高转化率。③恒压滴液漏斗代替分液漏斗可以平衡内外压强,使氨水顺利滴下。④反应后期随着CO2气流减慢,导致反应物比例不当,此时可以通过调节恒压滴液漏斗旋塞,减慢氨水滴加速度加以控制。(4)由于氨基甲酸铵是固体,所以产品易堵塞导管。又因为氨气极易溶于水,直接插入稀硫酸中吸收氨气,容易使稀硫酸倒吸。

 导学教程高中新课标系列答案
导学教程高中新课标系列答案