题目内容
【题目】废铅蓄电池量急速增加所引起的铅污染日益严重。工业上从废铅蓄电池的铅膏中回收铅的工艺流程如下:
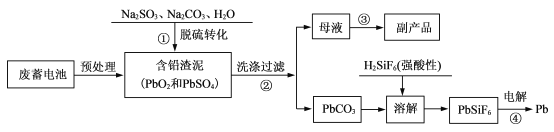
(1)铅蓄电池的总反应为Pb+ PbO2+2H2SO4 =2PbSO4+2H2O,该蓄电池放电时的负极反应式为__________,放电后该电极质量_______(填“增大”“减小”或“不变”)。
(2)步骤①中加入Na2SO3的作用是____________。
(3)写出步骤②证明PbCO3沉淀已经洗涤干净的实验操作方法:_______________。
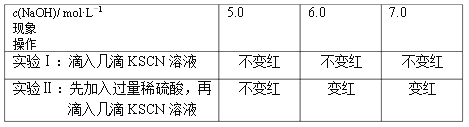
(4)若用NH4HCO3和NH3·H2O为脱硫转化剂,也可对上述流程中的含铅渣泥进行处理。如图是NH4 HCO3和NH3.H2O用量对含铅渣泥中脱硫率的影响:

从图形可以看出,应选择NH4HCO3和NH3·H2O用量为理论用量的__________倍。该条件下步骤③从母液可获得副产品为_______________ 。
(5)步骤④使用纯铅和粗铅作电极,PbSiF6作电解质,可进行粗铅精炼。则阳极的电极材料是_________,阴极的电极反应式为__________________。
【答案】(1)Pb-2e-+ SO42-=PbSO4(2分);增大(1分)(2)作为还原剂将PbO2还原(或其他合理答案)(2分)(3)取少许最后一次洗涤液于试管中,滴入过量盐酸后,再滴入少量氯化钡溶液,若无沉淀产生,则证明已经洗涤干净(3分);(4)2; (NH4)2SO4(各2分)(5)粗铅(1分);Pb2++2e- =Pb(2分)
【解析】
试题分析:(1)铅蓄电池的总反应为Pb+ PbO2+2H2SO4 =2PbSO4+2H2O,该蓄电池放电时的负极发生氧化反应,失去电子,只能是Pb失电子,变为硫酸铅固体;Pb-2e-+ SO42-=PbSO4;因为生成的Pb2+与SO42-不能共存,生成PbSO4,该电极质量增大;(2)Na2SO3具有还原性,能将PbO2还原为Pb2+;(3) )主要证明生成PbCO3后,溶液中是否还有CO2-3的剩余;具体操作如下:取少许最后一次洗涤液于试管中,滴入过量盐酸后,再滴入少量氯化钡溶液,若无沉淀产生,则证明已经洗涤干净;根据图像分析,H4HCO3和NH3·H2O用量为理论用量的2倍时,效率最高。Pb2+与CO2-生成沉淀PbCO3,则剩余的为NH4+与SO42-结合生成的(NH4)2SO4;(5)步骤④使用纯铅和粗铅作电极,PbSiF6作电解质,可进行粗铅精炼。则阳极的电极材料是粗铅,失去电子,发生氧化反应,阴极是溶液中Pb2+得电子还原为Pb,