题目内容
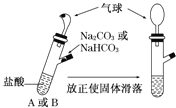
【题目】氯气极其相关产品在生产生活中应用广泛。
(1)氯气属于有毒气体,贮氯罐意外泄漏时,消防员会喷洒稀氢氧化钠溶液,其作用是__________。(用化学方程式表示)。
实验室常用NaOH溶液吸收多余的氯气,下列也可用于吸收氯气的是_________(填字母)。
a.NaCl溶液 b.FeSO4溶液 c.KMnO4溶液
(2)家庭中常用消毒液(主要成分NaClO)、洁厕灵(主要成分盐酸)等清洁卫生。某品牌消毒液包装上的说明如下图。

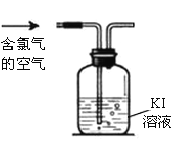
①分析“对金属制品有腐蚀作用”的原因:_______________。
②需“密闭保存”的原因:______________。
③“与洁厕灵同时使用”会产生有毒的氯气,请写出反应的离子方程式_____________。
(3)已知空气中氯气含量超过0.1mg/m3就会引起中毒。某液氯生产车间在一次测定空气中氯气的含量时,测得消耗0.001ml/L Kl溶液100mL,为了判断空气中氯气的含量是否超标,还需要获得的数据是_______。
【答案】 Cl2+2NaOH=NaCl+NaClO+H2O b NaClO有强氧化性,而一般金属具有较强还原性 消毒液的有效成分NaClO能与空气中的CO2作用,使其变质 Cl-+ClO-+2H+=Cl2↑+H2O 通入空气的体积
【解析】本题考查氯及其化合物的性质,(1)氯气与碱反应,其反应方程式为Cl2+2NaOH=NaCl+NaClO+H2O;氯气具有强氧化性,与还原性物质发生反应,A、氯气不与NaCl反应,故错误;B、Fe2+具有还原性,能与氯气反应,不产物有毒物质,故正确;C、KMnO4具有强氧化性,不与Cl2反应,故错误;(2)①因为NaClO具有强氧化性,而一般金属具有较强的还原性,两者发生氧化还原反应,对金属制品有腐蚀作用;②NaClO与空气中CO2发生:2NaClO+CO2+H2O=Na2CO3+2HClO,HClO见光受热分解,会使次氯酸钠失去漂白的性质,因此密封保存;③发生氧化还原反应,产生氯气,离子方程式为ClO-+Cl-+2H+=Cl2↑+H2O。

 名校课堂系列答案
名校课堂系列答案【题目】氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
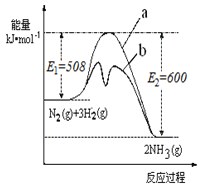
(1)根据如图提供的信息,写出该反应的热化学方程式 ,下图的曲线中 (填“a” 或“b”)表示加入铁触媒(催化剂)的能量变化曲线。
(2)在恒容容器中,下列描述中能说明上述反应已达
平衡的是 。
A.3υ(H2)正=2υ(NH3)逆
B.单位时间内生成n mol N2的同时生成2n molNH3
C.容器内气体的密度不随时间的变化而变化
D.容器内压强不随时间的变化而变化
(3)为了寻找合成NH3的适宜条件,某同学设计了三组实验(如下表),请在下表空格处填入相应的实验条件及数据。
实验编号 | T(℃) | n (N2)/n(H2) | P(MPa) |
ⅰ | 450 | 1/3 | 1 |
ⅱ | 1/3 | 10 | |
ⅲ | 480 | 10 |