题目内容
【题目】下列变化中,需要加入还原剂的是( )
A. Cl-→Cl2 B. FeCl3→FeCl2
C. C→CO2 D. KMnO4→K2MnO4
【答案】B
【解析】FeCl3→FeCl2的变化中铁元素的化合价由+3价降为+2价,需要加入还原剂才能实现。B正确。虽然 KMnO4→K2MnO4的变化中锰的化合价也降低了,但是,高锰酸钾自身分解就能生成锰酸钾。所以本题选B。

【题目】下表为元素周期表的一部分,用化学用语回答下列问题:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)⑧的原子结构示意图为________________________________。
(2)②和③气态氢化物稳定性的大小顺序:___________(填化学式)。
(3)③⑧⑩的最高价含氧酸的酸性最强的是__________(填化学式)。
(4)③的气态氢化物与③的最高价氧化物对应的水化物反应生成的盐是________(填化学式),它属于________(填“共价化合物”或“离子化合物”)。
(5)①④⑩三种元素的原子能形成原子数目比为1∶1∶1的共价化合物,它的电子式为________。
(6)欲比较④和⑨两种元素的非金属性强弱,可以作为验证的证据是________(填字母)。
A.比较这两种元素单质的沸点
B.比较这两种元素单质与氢气化合的难易
C.比较这两种元素的最高价氧化物对应水化物的酸碱性
D.比较这两种元素单质与酸或碱反应的难易性
【题目】(14分)Li4Ti3O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为Fe TiO3 , 还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如下图所示.由图可知,当铁的净出率为70%时,所采用的实验条件为 . 
(2)“酸浸”后,钛主要以TiOCl42﹣形式存在,写出相应反应的离子方程式 .
(3)TiO2xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2xH2O转化率/% | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2xH2O转化率最高的原因 .
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为 .
(5)若“滤液②”中c(Mg2+)=0.02molL﹣1 , 加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10﹣5 , 此时是否有Mg3(PO4)2沉淀生成?(列式计算).FePO4、Mg3(PO4)2的分别为1.3×10﹣22、1.0×10﹣24
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式 .
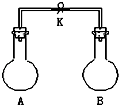
【题目】如图所示,室温下,A、B两个容积相等的烧瓶中分别集满了两种气体(同温、同压),当取下K夹,使两烧瓶内气体充分接触后,容器内压强由小到大的顺序正确的是( )
编 号 | ① | ② | ③ | ④ |
A中气体 | H2S | H2 | NH3 | NO |
B中气体 | SO2 | Cl2 | HCl | O2 |
A.②③④①
B.③①④②
C.③②①④
D.④③②①