题目内容
某化学研究性学习小组对硫酸铜分解气体产物的成分进行如下探究:
【查阅资料】
硫酸铜受热分解生成氧化铜和气体,温度不同时,气体可能为SO3,SO2和O2中的一种、两种或三种。
【提出假设】
假设1:气体产物只有一种;
假设2:气体产物只有两种;
假设3:气体产物有三种。
(1)若假设1成立,则产物气体的成分是 ;若假设2成立,则产物气体的成分是 。
【实验及结果讨论】
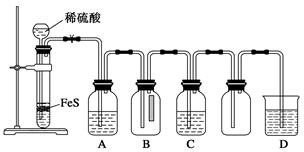
(2)甲同学将分解生成的气体依次通过盛浓硫酸和KMnO4酸性溶液的洗气瓶,能说明产物气体中含SO2的现象是 ,该现象说明SO2具有的性质是 ,实验中还发现盛浓硫酸的洗气瓶质量明显增加,原因是 。
(3)乙同学将分解生成的气体通过碱石灰后,再收集测定剩余气体的体积,在不同温度下进行3组实验。请完成下表(实验中硫酸铜均完全分解):
【查阅资料】
硫酸铜受热分解生成氧化铜和气体,温度不同时,气体可能为SO3,SO2和O2中的一种、两种或三种。
【提出假设】
假设1:气体产物只有一种;
假设2:气体产物只有两种;
假设3:气体产物有三种。
(1)若假设1成立,则产物气体的成分是 ;若假设2成立,则产物气体的成分是 。
【实验及结果讨论】
(2)甲同学将分解生成的气体依次通过盛浓硫酸和KMnO4酸性溶液的洗气瓶,能说明产物气体中含SO2的现象是 ,该现象说明SO2具有的性质是 ,实验中还发现盛浓硫酸的洗气瓶质量明显增加,原因是 。
(3)乙同学将分解生成的气体通过碱石灰后,再收集测定剩余气体的体积,在不同温度下进行3组实验。请完成下表(实验中硫酸铜均完全分解):
| 实验 序号 | 称取CuSO4 的质量/g | 碱石灰的 增加质量/g | 剩余气体的体积(折算 成标准状况下)/mL | 结论 |
| Ⅰ | 6.4 | | | 假设1成立 |
| Ⅱ | 6.4 | 2.88 | 224 | |
| Ⅲ | 6.4 | 2.56 | 448 | |
(1)SO3 SO2和O2
(2)高锰酸钾酸性溶液颜色变浅或褪色 还原性 浓硫酸吸收了SO3
(3)
(2)高锰酸钾酸性溶液颜色变浅或褪色 还原性 浓硫酸吸收了SO3
(3)
| | | | | |
| | | 3.2 | 0 | |
| | | | | 假设3成立 |
| | | | | 假设2成立 |
(1)若CuSO4分解在生成CuO的同时,只生成一种气体,则此过程定为非氧化还原反应,此气体只能是SO3;若生成两种气体,则此过程必为氧化还原反应,有SO2生成必有O2生成;(2)SO2能使酸性KMnO4溶液褪色;浓H2SO4除了吸收H2O(g)质量增加外,还可吸收SO3。(3)乙同学实验中,n(CuSO4)=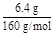 ="0.04" mol,若假设1成立,则n(SO3)="0.04" mol,无其他气体生成,所以碱石灰增重即吸收SO3的质量:0.04 mol×80 g·mol-1="3.2" g,剩余气体体积为0;Ⅱ中,n(O2)=
="0.04" mol,若假设1成立,则n(SO3)="0.04" mol,无其他气体生成,所以碱石灰增重即吸收SO3的质量:0.04 mol×80 g·mol-1="3.2" g,剩余气体体积为0;Ⅱ中,n(O2)=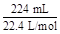 ="0.01" mol,由2SO3
="0.01" mol,由2SO3 2SO2+O2知:n(SO3)="0.02" mol,再由S原子守恒:知n(SO2)="0.04" mol-0.02 mol="0.02" mol,假设3成立;Ⅲ中,n(O2)=
2SO2+O2知:n(SO3)="0.02" mol,再由S原子守恒:知n(SO2)="0.04" mol-0.02 mol="0.02" mol,假设3成立;Ⅲ中,n(O2)= 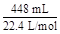 ="0.02" mol,则n(SO2)="0.04" mol,由S原子守恒知:此时无SO3生成,则假设2成立。
="0.02" mol,则n(SO2)="0.04" mol,由S原子守恒知:此时无SO3生成,则假设2成立。
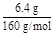 ="0.04" mol,若假设1成立,则n(SO3)="0.04" mol,无其他气体生成,所以碱石灰增重即吸收SO3的质量:0.04 mol×80 g·mol-1="3.2" g,剩余气体体积为0;Ⅱ中,n(O2)=
="0.04" mol,若假设1成立,则n(SO3)="0.04" mol,无其他气体生成,所以碱石灰增重即吸收SO3的质量:0.04 mol×80 g·mol-1="3.2" g,剩余气体体积为0;Ⅱ中,n(O2)=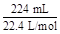 ="0.01" mol,由2SO3
="0.01" mol,由2SO3 2SO2+O2知:n(SO3)="0.02" mol,再由S原子守恒:知n(SO2)="0.04" mol-0.02 mol="0.02" mol,假设3成立;Ⅲ中,n(O2)=
2SO2+O2知:n(SO3)="0.02" mol,再由S原子守恒:知n(SO2)="0.04" mol-0.02 mol="0.02" mol,假设3成立;Ⅲ中,n(O2)= 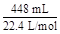 ="0.02" mol,则n(SO2)="0.04" mol,由S原子守恒知:此时无SO3生成,则假设2成立。
="0.02" mol,则n(SO2)="0.04" mol,由S原子守恒知:此时无SO3生成,则假设2成立。
练习册系列答案
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目

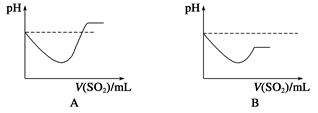
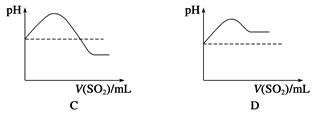
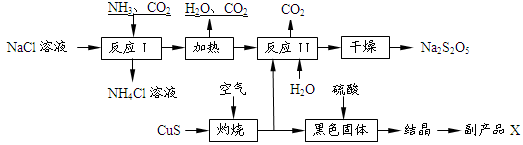
 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。 HSO3-+OH-水解平衡的事实是________(填序号)。
HSO3-+OH-水解平衡的事实是________(填序号)。