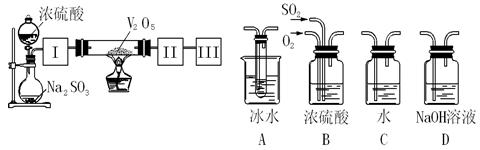
题目内容
直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:______________________________________________________________。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是____________________________________________________。
(3)吸收液吸收SO2的过程中,pH随n(SO32-)∶n(HSO3-)变化关系如下表:
①由上表判断,NaHSO3溶液显________性,用化学平衡原理解释:_____________。
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):________。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(4)(2012·福建高考节选)能证明Na2SO3溶液中存在SO32-+H2O HSO3-+OH-水解平衡的事实是________(填序号)。
HSO3-+OH-水解平衡的事实是________(填序号)。
A.滴入酚酞溶液变红,再加入H2SO4溶液后红色褪去
B.滴入酚酞溶液变红,再加入氯水后红色褪去
C.滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:______________________________________________________________。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是____________________________________________________。
(3)吸收液吸收SO2的过程中,pH随n(SO32-)∶n(HSO3-)变化关系如下表:
| n(SO32-)∶n(HSO3-) | 91∶9 | 1∶1 | 9∶91 |
| pH | 8.2 | 7.2 | 6.2 |
①由上表判断,NaHSO3溶液显________性,用化学平衡原理解释:_____________。
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):________。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
(4)(2012·福建高考节选)能证明Na2SO3溶液中存在SO32-+H2O
 HSO3-+OH-水解平衡的事实是________(填序号)。
HSO3-+OH-水解平衡的事实是________(填序号)。A.滴入酚酞溶液变红,再加入H2SO4溶液后红色褪去
B.滴入酚酞溶液变红,再加入氯水后红色褪去
C.滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去
(1)SO2+H2O??H2SO3、2H2SO3+O2 2H2SO4
2H2SO4
(2)2OH-+SO2=H2O+SO32-
(3)①酸 HSO3-存在:HSO3- H++SO32-和HSO3-+H2O
H++SO32-和HSO3-+H2O H2SO3+OH-,HSO的电离程度大于水解程度
H2SO3+OH-,HSO的电离程度大于水解程度
②ab
(4)C
 2H2SO4
2H2SO4(2)2OH-+SO2=H2O+SO32-
(3)①酸 HSO3-存在:HSO3-
 H++SO32-和HSO3-+H2O
H++SO32-和HSO3-+H2O H2SO3+OH-,HSO的电离程度大于水解程度
H2SO3+OH-,HSO的电离程度大于水解程度②ab
(4)C
(1)二氧化硫形成硫酸型酸雨的过程为二氧化硫与水反应生成亚硫酸,亚硫酸再被氧化成硫酸。
(2)氢氧化钠溶液吸收二氧化硫生成亚硫酸钠和水,而亚硫酸钠溶液可以继续吸收二氧化硫生成亚硫酸氢钠。
(3)①由表格数据知,随n(HSO3-)的增大,溶液酸性增强,即HSO3-的电离程度大于水解程度,亚硫酸氢钠溶液呈酸性。②由表格数据知,当溶液中亚硫酸氢钠的浓度略大于亚硫酸钠的浓度时,溶液呈中性,故离子浓度关系有c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-),b正确。由电荷守恒式c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),中性溶液中c(H+)=c(OH-)知,a正确,c错误。
(4)H2SO4溶液显酸性、氯水具有漂白作用,A、B均不能证明平衡移动了;加入BaCl2溶液后,平衡发生移动。
(2)氢氧化钠溶液吸收二氧化硫生成亚硫酸钠和水,而亚硫酸钠溶液可以继续吸收二氧化硫生成亚硫酸氢钠。
(3)①由表格数据知,随n(HSO3-)的增大,溶液酸性增强,即HSO3-的电离程度大于水解程度,亚硫酸氢钠溶液呈酸性。②由表格数据知,当溶液中亚硫酸氢钠的浓度略大于亚硫酸钠的浓度时,溶液呈中性,故离子浓度关系有c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-),b正确。由电荷守恒式c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),中性溶液中c(H+)=c(OH-)知,a正确,c错误。
(4)H2SO4溶液显酸性、氯水具有漂白作用,A、B均不能证明平衡移动了;加入BaCl2溶液后,平衡发生移动。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

 2SO3(g) ΔH <0,现将0.050 mol SO2和0.030 mol O2充入容积为1 L的密闭容器中,反应在一定条件下达到平衡,测得反应后容器压强缩小到原来压强的75%,则该条件下SO2的转化率为 ;该条件下的平衡常数为 。
2SO3(g) ΔH <0,现将0.050 mol SO2和0.030 mol O2充入容积为1 L的密闭容器中,反应在一定条件下达到平衡,测得反应后容器压强缩小到原来压强的75%,则该条件下SO2的转化率为 ;该条件下的平衡常数为 。

 HSO3—+OH—,所以滴入酚酞变红;
HSO3—+OH—,所以滴入酚酞变红;