题目内容
实验室有NaHSO4、Ba(OH)2、NH3·H2O、NaHCO3、KAl(SO4)2五种无
色溶液,现欲通过它们之间的相互反应的现象对其进行鉴别。部分物质间的反应现象如下表。
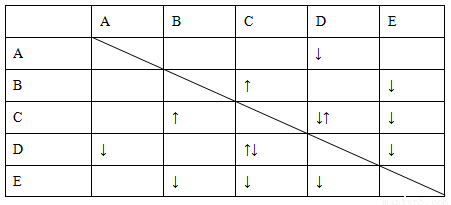
表中“↑”表示生成气体物质,“↓”表示生成沉淀。
根据以上信息,回答以下问题。
(1)B、E的化学式分别为________、________。
(2)写出A的电离方程式:________。
(3)C、D两溶液反应的离子方程式为________。
(4)向含有0.1 mol溶液的D溶液中滴加E溶液,所生成沉淀的物质的量之和最多为________mol。
(1)NaHSO4 Ba(OH)2
(2)NH3·H2O NH4++OH-
NH4++OH-
(3)Al3++3HCO3—=Al(OH)3↓+3CO2↑
(4)0.25
【解析】(1)C与D反应生成气体和沉淀,则C、D分别是NaHCO3、KAl(SO4)2中的一种;B与C反应只有气体生成,则B、C分别是NaHSO4、NaHCO3中的一种;据此可知C是NaHCO3,则D是KAl(SO4)2,B是NaHSO4;又由于E与B、C、D反应都有沉淀生成,故E是Ba(OH)2,A是NH3·H2O。(2)NH3·H2O是弱电解质,书写其电离方程式时要用可逆符号。(3)Al3+与HCO3—发生相互促进的水解反应。(4)当KAl(SO4)2与Ba(OH)2按1∶1.5的物质的量之比混合时,Al3+恰好完全沉淀,反应方程式为2KAl(SO4)2+3Ba(OH)2=2Al(OH)3↓+3BaSO4↓+K2SO4;当KAl(SO4)2与Ba(OH)2按1∶2的物质的量之比混合时,SO42—完全沉淀,反应方程式为KAl(SO4)2+2Ba(OH)2=KAlO2+2BaSO4↓+2H2O。可见,当KAl(SO4)2与Ba(OH)2按1∶1.5的物质的量之比混合时,生成沉淀的物质的量最多。观察反应方程式可知0.1 mol KAl(SO4)2参与反应时生成0.25 mol沉淀。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案