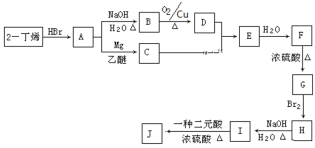
题目内容
【题目】室温下,将0.1molL-1NaOH溶液逐滴滴入10mL0.1molL-1NH4HSO4溶液中,溶液的pH与NaOH溶液体积关系如图所示:下列关系中,不正确的是
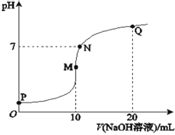
A.M点c(Na+)>c(NH4+)
B.N点c(NH4+)+c(Na+)=2c(SO42-)
C.Q点c(NH4+)+c(NH3H2O)=c(Na+)
D.M、N、Q三点中,水的电离程度M>N>Q
【答案】C
【解析】
P点氢氧化钠溶液体积为0,此时为NH4HSO4溶液,NH4HSO4为强电解质,在溶液中完全电离:NH4HSO4=NH4++H++SO42溶液呈酸性,根据图示可知,M点加入10mLNaOH溶液,此时二者恰好反应生成硫酸钠和硫酸铵,铵根离子发生水解,促进了水的电离;Q点加入20mLNaOH溶液,此时溶质为硫酸钠和NH3H2O,氨水电离出的氢氧根离子抑制了水的电离,所以水的电离程度较大的为M点。
A.M点溶质为等浓度的硫酸钠和硫酸铵,由于铵根离子部分水解,导致铵根离子浓度减小,则c(Na+)>c(NH4+),故A正确;
B.室温下,N点pH=7,N点溶液呈中性,则c(H+)=c(OH),结合电荷守恒可知:c(NH4+)+c(Na+)=2c(SO42),故B正确;
C.Q点溶质为等浓度的硫酸钠和一水合氨,结合物料守恒可知:2c(NH4+)+2c(NH3H2O)=c(Na+),故C错误;
D.根据图示可知,P点呈强酸性,抑制了水的电离;M点加入10mLNaOH溶液,此时二者恰好反应生成硫酸钠和硫酸铵,铵根离子发生水解,促进了水的电离;N点为中性,不影响水的电离;Q点加入20mLNaOH溶液,此时溶质为硫酸钠和NH3H2O,氨水电离出的氢氧根离子抑制了水的电离;所以水的电离程度较大的为M点,水的电离程度M>N>Q,故D正确;
答案选C。

【题目】在2 L密闭容器内,800℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)800℃,反应达到平衡时,NO的物质的量浓度为__________ mol/L;升高温度,NO的浓度增大,则该反应是________(填“放热”或“吸热”)反应。
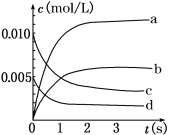
(2)如下图中表示NO2变化的曲线是________(填字母序号a、b、c、d)。用O2表示从0~2 s内该反应的平均速率v=________ mol/(L·s)。
(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂