题目内容
11.下列物质中,酸性最强的是( )| A. | 乙醇 | B. | 碳酸 | C. | 苯酚 | D. | 乙酸 |
分析 A、乙醇中羟基中H不能电离,不具有酸性;
B、碳酸的酸性弱于醋酸;
C、苯酚的酸性弱于碳酸;
D、乙酸即为醋酸,酸性较强.
解答 解:A、乙醇中羟基中H不能电离,不具有酸性;
B、碳酸的酸性弱于醋酸;
C、苯酚的酸性弱于碳酸;
D、乙酸即为醋酸,酸性较强,故在此四种物质中酸性最强的是乙酸,
故选D.
点评 本题主要考查的是常见有机物的酸性强弱比较,掌握官能团的结构以及性质是解决本题的关键,难度不大.

练习册系列答案
相关题目
2.下列操作中,能使水的电离平衡H2O?H++OH-向右移动且溶液呈酸性的是( )
| A. | 向水中加入KHSO4溶液 | B. | 向水中加入AlCl3溶液 | ||
| C. | 向水中加入Na2CO3溶液 | D. | 将水加热到100℃,使pH=6 |
6.下列分子中的中心原子的杂化方式都为sp杂化,分子的空间构型都为直线形,分子中没有形成π键的是( )
| A. | BeCl2 | B. | C2H2 | C. | CO2 | D. | HCN |
16.下列糖类,属于还原型二糖的是( )
| A. | 葡萄糖 | B. | 麦芽糖 | C. | 蔗糖 | D. | 淀粉 |
3.下列对有机物C6H12O2结构的猜测不正确的是( )
| A. | 分子中可能含有一个醛基、一个羟基 | |
| B. | 分子中可能含有一个碳碳双键、两个羟基 | |
| C. | 六个碳原子可能连成环状 | |
| D. | 分子中可能含有一个羧基、一个碳碳双键 |
20.已知反应A2(g)+2B2(g)?2AB2(g)的△H<0,下列说法正确的是( )
| A. | 升高温度,A2转化率增大 | |
| B. | 升高温度有利于速率增大,从而缩短达到平衡的时间 | |
| C. | 达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动 | |
| D. | 达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 |
6.以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如图所示:

(1)酸溶过程中为提高铁的浸出率,可采取的措施有适当提高反应温度(增加浸出时间;增大硫酸的浓度;研磨硫酸渣,增大固体表面积)(要求写出一条).“滤渣A”主要成份的化学式为SiO2.
(2)还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式:FeS2+14Fe3++8H2O═15Fe2++2SO42-.
(3)氧化过程中,O2、NaOH与Fe2+反应的离子方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓.
(4)为了确保铁红的质量,氧化过程需要调节溶液的pH的范围是3.2-3.8(几种离子沉淀的pH见表);滤液B可以回收的物质有(写化学式)Na2SO4、Al2(SO4)3、MgSO4,.

(1)酸溶过程中为提高铁的浸出率,可采取的措施有适当提高反应温度(增加浸出时间;增大硫酸的浓度;研磨硫酸渣,增大固体表面积)(要求写出一条).“滤渣A”主要成份的化学式为SiO2.
(2)还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式:FeS2+14Fe3++8H2O═15Fe2++2SO42-.
(3)氧化过程中,O2、NaOH与Fe2+反应的离子方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓.
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
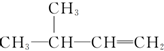 3-甲基-1-丁烯
3-甲基-1-丁烯 3-甲基-2-丁醇.
3-甲基-2-丁醇. ,该反应类型是加聚反应.
,该反应类型是加聚反应.