题目内容
【题目】I.25℃时,往25ml氢氧化钠标准溶液中逐滴加入0.2 mol·L-1的一元酸HA溶液,pH变化曲线如下图所示:

(1)该氢氧化钠溶液的物质的量浓度为________mol·L-1。
(2)A点对应酸的体积为12.5ml,则所得混合溶液中由水电离出的c(OH-)=_______ mol·L-1。
(3)HA是________酸(选填“强”、“弱”)。NaA的水溶液显________性(选填“酸”、“碱”),原因是:________(用离子方程式表示)。
(4)在B点所得混合溶液中,c(Na+) 、c(A-)、c(H+)、c(OH-)由大到小的顺序是_________。
(5)在C点所得混合溶液中,下列说正确的是:___________。
A.HA的电离程度小于NaA的水解程度
B.离子浓度由大到小的顺序是c(Na+) >c(A-)>c(H+)> c(OH-)。
C.c(Na+) +c(H+)=c(A─) +c(OH-)
D.c(HA)+c(A-)=0.2mol·L-1
Ⅱ.在25 ℃的条件下,某些弱酸的电离平衡常数。
化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
(1)温度、浓度相同的CH3COOH和HClO溶液,水的电离程度前者________ 后者(填“>”“=”或“<”)。
(2)相同温度下,pH相同的NaClO和CH3COOK两种溶液中,c(CH3COOK)________c(NaClO) (填“>”“=”或“<”),[c(Na+)-c(ClO-)]_______[c(K+)-c(CH3COO-)](填“>”“=”或“<”)。
(3)在25 ℃的条件下,向0.1 mol·L-1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH)∶c(CH3COO-)=5∶9,此时溶液pH=________。
【答案】 0.1 1×10-4 弱 碱 A-+H2O![]() HA+OH- c(Na+) =c(A-)>c(H+)=c(OH-) C < > = 5
HA+OH- c(Na+) =c(A-)>c(H+)=c(OH-) C < > = 5
【解析】试题分析:I.(1)根据起点溶液的PH=13计算氢氧化钠溶液的物质的量浓度;(2)25ml 0.1 mol·L-1氢氧化钠溶液中逐滴加入12.5ml 0.2 mol·L-1的一元酸HA溶液,恰好反应生成NaA,A点溶液的PH=10,说明NaA水解促进水电离;(3)根据图像,氢氧化钠溶液与一元酸HA溶液恰好完全反应时,溶液PH=10,说明NaA是强碱弱酸盐,A-水解。(4)根据电荷守恒、溶液呈中性判断B点所得混合溶液中,c(Na+) 、c(A-)、c(H+)、c(OH-)的大小顺序;(5)25ml 0.1 mol·L-1氢氧化钠溶液中逐滴加入25ml 0.2 mol·L-1的一元酸HA溶液,所得混合溶液中含有等浓度的NaA、HA;Ⅱ.(1)根据弱酸的弱酸的电离平衡常数,醋酸的酸性大于次氯酸,温度、浓度相同的CH3COOH和HClO溶液,醋酸电离出氢离子浓度大于次氯酸,醋酸对水的电离抑制作用强;(2)醋酸的酸性大于次氯酸, NaClO比 CH3COOK更易水解;根据电荷守恒[c(Na+)-c(ClO-)]= c(OH-) -c(H+)、[c(K+)-c(CH3COO-)] = c(OH-) -c(H+);(3)在25 ℃,醋酸Ka=1.8×10-5, 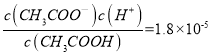 ,带入c(CH3COOH)∶c(CH3COO-)=5∶9,得c(H+)=10-5。
,带入c(CH3COOH)∶c(CH3COO-)=5∶9,得c(H+)=10-5。
解析:I.(1)25℃时,起点溶液的PH=13, ![]() ,
, ![]() ,所以氢氧化钠溶液的物质的量浓度为0.1 mol·L-1;(2)25ml 0.1 mol·L-1氢氧化钠溶液中逐滴加入12.5ml 0.2 mol·L-1的一元酸HA溶液,恰好反应生成NaA,A点溶液的PH=10,溶液中
,所以氢氧化钠溶液的物质的量浓度为0.1 mol·L-1;(2)25ml 0.1 mol·L-1氢氧化钠溶液中逐滴加入12.5ml 0.2 mol·L-1的一元酸HA溶液,恰好反应生成NaA,A点溶液的PH=10,溶液中![]() ,
, ![]() , NaA水解促进水电离,由水电离出的
, NaA水解促进水电离,由水电离出的![]() ;(3)根据图像,氢氧化钠溶液与一元酸HA溶液恰好完全反应时,溶液PH=10,说明NaA是强碱弱酸盐,HA是弱酸,NaA的水溶液显碱性,A-水解的方程式是A-+H2O
;(3)根据图像,氢氧化钠溶液与一元酸HA溶液恰好完全反应时,溶液PH=10,说明NaA是强碱弱酸盐,HA是弱酸,NaA的水溶液显碱性,A-水解的方程式是A-+H2O![]() HA+OH-;(4)根据电荷守恒c(Na+)+c(H+)=c(A-)+c(OH-),B点溶液呈中性c(H+)=c(OH-),所以B点所得混合溶液中,离子的大小顺序是c(Na+) =c(A-)>c(H+)=c(OH-);(5)25ml 0.1 mol·L-1氢氧化钠溶液中逐滴加入25ml 0.2 mol·L-1的一元酸HA溶液,所得混合溶液中含有等浓度的NaA、HA;C点溶液呈酸性,NaA水解程度小于HA,故A错误;C点溶液呈酸性,NaA水解程度小于HA,C点溶液离子浓度由大到小的顺序是c(A-)>c(Na+) >c(H+)> c(OH-),故B错误;根据电荷守恒c(Na+) +c(H+)=c(A─) +c(OH-),故C正确;根据物料守恒c(HA)+c(A-)=0.1mol·L-1,故D错误。Ⅱ.(1)温度、浓度相同的CH3COOH和HClO溶液,醋酸电离出氢离子浓度大于次氯酸,醋酸对水的电离抑制作用强,水电离的氢离子CH3COOH<HClO;(2)醋酸的酸性大于次氯酸, NaClO比 CH3COOK更易水解,所以相同温度下,pH相同的NaClO和CH3COOK两种溶液中,c(CH3COOK)>c(NaClO);根据电荷守恒[c(Na+)-c(ClO-)]= c(OH-) -c(H+)、[c(K+)-c(CH3COO-)] = c(OH-) -c(H+),溶液PH相同,所以[c(Na+)-c(ClO-)]=[c(K+)-c(CH3COO-)];在25 ℃,醋酸Ka=1.8×10-5,
HA+OH-;(4)根据电荷守恒c(Na+)+c(H+)=c(A-)+c(OH-),B点溶液呈中性c(H+)=c(OH-),所以B点所得混合溶液中,离子的大小顺序是c(Na+) =c(A-)>c(H+)=c(OH-);(5)25ml 0.1 mol·L-1氢氧化钠溶液中逐滴加入25ml 0.2 mol·L-1的一元酸HA溶液,所得混合溶液中含有等浓度的NaA、HA;C点溶液呈酸性,NaA水解程度小于HA,故A错误;C点溶液呈酸性,NaA水解程度小于HA,C点溶液离子浓度由大到小的顺序是c(A-)>c(Na+) >c(H+)> c(OH-),故B错误;根据电荷守恒c(Na+) +c(H+)=c(A─) +c(OH-),故C正确;根据物料守恒c(HA)+c(A-)=0.1mol·L-1,故D错误。Ⅱ.(1)温度、浓度相同的CH3COOH和HClO溶液,醋酸电离出氢离子浓度大于次氯酸,醋酸对水的电离抑制作用强,水电离的氢离子CH3COOH<HClO;(2)醋酸的酸性大于次氯酸, NaClO比 CH3COOK更易水解,所以相同温度下,pH相同的NaClO和CH3COOK两种溶液中,c(CH3COOK)>c(NaClO);根据电荷守恒[c(Na+)-c(ClO-)]= c(OH-) -c(H+)、[c(K+)-c(CH3COO-)] = c(OH-) -c(H+),溶液PH相同,所以[c(Na+)-c(ClO-)]=[c(K+)-c(CH3COO-)];在25 ℃,醋酸Ka=1.8×10-5, 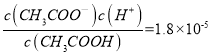 ,带入c(CH3COOH)∶c(CH3COO-)=5∶9,得c(H+)=10-5,所以PH=5。
,带入c(CH3COOH)∶c(CH3COO-)=5∶9,得c(H+)=10-5,所以PH=5。

 全能测控一本好卷系列答案
全能测控一本好卷系列答案