题目内容
用6.02×1023表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、T℃时,1 L pH=6纯水中,约含6.02×1017个OH- |
| B、6.8g熔融的KHSO4中含有6.02×1022个阳离子 |
| C、Na2O2与H2O反应,生成常温常压下16g O2,反应中转移电子数为2NA |
| D、用含有0.1mol FeCl3的饱和溶液制得的氢氧化铁胶体中,胶粒个数等于0.1NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.纯水中氢离子与氢氧根离子浓度相等,根据纯水中氢离子浓度计算出溶液中氢氧根离子的数目;
B.熔融硫酸氢钾电离出钾离子和硫酸氢根离子,6.8g硫酸氢钾的物质的量为0.05mol,含有0.05mol阳离子;
C.过氧化钠中氧元素的化合价为-1价,生成16g氧气的物质的量为0.5mol,转移了1mol电子;
D.氢氧化铁胶体为氢氧化铁的聚集体,无法计算氢氧化铁胶体中含有的氢氧化铁胶粒的数目.
B.熔融硫酸氢钾电离出钾离子和硫酸氢根离子,6.8g硫酸氢钾的物质的量为0.05mol,含有0.05mol阳离子;
C.过氧化钠中氧元素的化合价为-1价,生成16g氧气的物质的量为0.5mol,转移了1mol电子;
D.氢氧化铁胶体为氢氧化铁的聚集体,无法计算氢氧化铁胶体中含有的氢氧化铁胶粒的数目.
解答:
解:A.pH=6的纯水中,氢离子浓度为1×10-61mol/L,1L纯水中含有1×10-6mol氢离子,纯水中氢离子与氢氧根离子的物质的量相等,则该纯水中含有氢氧根离子数目为6.02×1017个OH-,故A正确;
B.6.8g熔融硫酸氢钾的物质的量为0.05mol,0.05mol熔融硫酸氢钾中含有0.05mol钾离子,含有3.01×1022个阳离子,故B错误;
C.16g氧气的物质的量为0.5mol,过氧化钠与水反应生成0.5mol氧气转移了1mol电子,转移电子数为NA,故C错误;
D.氢氧化铁胶体中,氢氧化铁胶粒为氢氧化铁的聚集体,无法计算氢氧化铁胶体中含有的胶粒数目,故D错误;
故选A.
B.6.8g熔融硫酸氢钾的物质的量为0.05mol,0.05mol熔融硫酸氢钾中含有0.05mol钾离子,含有3.01×1022个阳离子,故B错误;
C.16g氧气的物质的量为0.5mol,过氧化钠与水反应生成0.5mol氧气转移了1mol电子,转移电子数为NA,故C错误;
D.氢氧化铁胶体中,氢氧化铁胶粒为氢氧化铁的聚集体,无法计算氢氧化铁胶体中含有的胶粒数目,故D错误;
故选A.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确熔融硫酸氢钾中的阳离子只有钾离子,选项D为易错点,注意氢氧化铁胶体为氢氧化铁的聚集体.

练习册系列答案
 快捷英语周周练系列答案
快捷英语周周练系列答案
相关题目
新型高效多功能水处理剂Na2FeO4的制备方法可用化学方程式表示为:
2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
对此反应下列说法不正确的是( )
2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
对此反应下列说法不正确的是( )
| A、在反应中Na2FeO4只是氧化产物 | ||
B、在反应中有
| ||
| C、2mol FeSO4发生反应时,共有10mol电子转移 | ||
| D、此反应氧化剂为Na2O2 |
下列指定溶液中,各组离子可能大量共存的是( )
| A、pH=1的溶液中:K+、Fe2+、Cl-、NO3- |
| B、在强酸溶液中:Na+、ClO-、Cl-、Ba2+ |
| C、在含有大量Fe3+的溶液中:NH4+、Cl-、Na+、SCN- |
| D、由水电离的c(H+)=10-13mol?L-1的溶液中:Mg2+、Cl-、K+、SO42- |
某原电池的结构如图所示,下列有关该原电池的说法正确的是( )
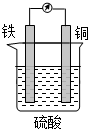

| A、该电池工作时电能转变为化学能 |
| B、铜片的质量增加 |
| C、H+向铁片移动 |
| D、铁片上发生的反应是Fe-2e-═Fe2+ |
下列表示物质结构的化学用语或模型图正确的是( )
| A、HClO的结构式:H-Cl-O |
B、NH3分子的电子式: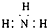 |
C、CO2的比例模型: |
D、18O的原子结构示意图: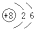 |
 甲烷分子中4个氢原子被苯基取代,如图所示,对该分子描述正确的是( )
甲烷分子中4个氢原子被苯基取代,如图所示,对该分子描述正确的是( )| A、该物质属于芳香烃,是苯的同系物 |
| B、所有的碳原子可能在同一平面 |
| C、此物质属于高分子化合物 |
| D、此分子的一氯取代物有3种 |
下列不属于氧化还原反应的是( )
| A、2KMnO4+5SO2+2H2O═K2SO4+2MnSO4+2H2SO4 |
| B、工业制漂白粉 |
| C、氯碱工业制氯气 |
| D、Na2O2+2HCl═2NaCl+H2O2 |
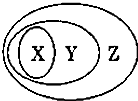 用如图表示的一些物质或概念间的从属关系中,正确的是( )
用如图表示的一些物质或概念间的从属关系中,正确的是( )