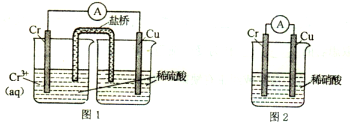
题目内容
13.下列各组气体,通常情况下能共存,并且能用浓硫酸和碱石灰干燥的是( )| A. | H2、O2 | B. | SO2、H2S | C. | NO、O2 | D. | HCl、NH3 |
分析 气体之间不发生反应,则能够共存;只要干燥剂和被干燥的气体不反应,则该干燥剂能干燥这种气体,能用浓硫酸和碱石灰干燥,说明这些气体和浓硫酸、碱石灰都不反应,应该为中性气体,据此分析解答.
解答 解:A.H2、O2之间不反应,且都不与浓硫酸、碱石灰反应,所以都能用浓硫酸和碱石灰干燥,故A正确;
B.SO2、H2S能够发生反应,不能共存,且二氧化硫和硫化氢都能够与碱石灰反应,不能用碱石灰干燥,故B错误;
C.NO和氧气反应生成二氧化氮,二者不能共存,故C错误;
D.HCl、NH3之间反应生成氯化铵,二者不能共存,故D错误;
故选A.
点评 本题考查了气体的性质及干燥剂的选用,题目难度不大,明确常见气体的性质及干燥剂的特点为解答关键,试题侧重考查学生灵活应用基础知识的能力.

练习册系列答案
相关题目
3.能完全中和1.5molNaOH的物质是( )
| A. | 0.75mol硫酸 | B. | 0.75盐酸 | C. | 0.5mol硝酸 | D. | 0.75mol醋酸 |
1.下列各组选项中,前者为垃圾类别,后者为处理方法,其中不合理的是( )
| A. | 废旧塑料--回收再利用 | B. | 医疗垃圾--焚烧 | ||
| C. | 厨余垃圾--堆肥 | D. | 废旧电池--填埋 |
8.短周期元素W、X、Y、Z的原子序数依次增大.金属W是制备手机电池的常用材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是它的电子层数的2倍.下列说法正确的是( )
| A. | W的金属性是同主族元素中最强的 | |
| B. | X、Z形成的化合物为离子化合物 | |
| C. | X最高价氧化物对应的水化物的酸性小于Z的最高价氧化物对应的水化物 | |
| D. | 原子半径Y>Z,离子半径Y3+<Z2- |
5.1.92g Cu投入到一定量的浓HNO3中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下672mL气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的O2,恰好使气体完全溶于水,则通入O2的体积为( )
| A. | 504 mL | B. | 168 mL | C. | 224 mL | D. | 336 ml |
2.下列反应对应的离子方程式正确的是( )
| A. | 钠与水反应:Na+2H2O=Na++2OH-+H2↑ | |
| B. | 大理石与醋酸:CaCO3+2H+=Ca2++H2O+CO2 | |
| C. | 碳酸氢钙溶液中加入石灰水:Ca2++2HCO3-+2OH-=CaCO3+CO32-+2H2O | |
| D. | 明矾溶于水:Al3++3H2O?Al(OH)3+3H+ |
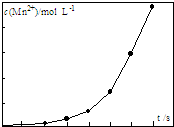 由软锰矿制备高锰酸钾的主要反应如下:
由软锰矿制备高锰酸钾的主要反应如下: