题目内容
【题目】已知硫酸、氨水的密度与所加水量的关系如下图所示:

现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
溶液 | 溶质的物质的量浓度 | 溶液的密度/g·cm-3 |
硫酸 | 4 mol·L-1 | ρ1 |
2 mol·L-1 | ρ2 | |
氨水 | 4 mol·L-1 | ρ3 |
2 mol·L-1 | ρ4 |
(1)ρ1、ρ2、ρ3、ρ4由大到小的顺序为:________。
(2)表中2 mol·L-1氨水的质量分数为:________。
(3)将4 mol·L-1的氨水与2 mol·L-1的硫酸等体积混合,所得溶液呈______性(填“酸”、“碱”、“中”);溶液中离子浓度从大到小的顺序是:___________________。
(4)将20%的硫酸与10%的硫酸等体积混合,所得硫酸溶液的质量分数是______。
A.>15% B.=15% C.<15% D.无法判断
(5)100g浓度为4 mol·L-1的硫酸溶液与_____mL水混合,可以使硫酸的物质的量浓度减小到2 mol·L-1。
【答案】 ρ1>ρ2>ρ4>ρ3 (3.4/ρ4)% 酸 c(NH4+)>c(SO42-)>c(H+)>c(OH-) A (200ρ2-100ρ1)/ ρ1
【解析】(1)硫酸的密度大于水的密度,氨水的密度小于水的密度,所以ρ1、ρ2>ρ4、ρ3,硫酸的密度大于水的密度,浓度越大,密度越大,ρ1>ρ2氨水的密度小于水的密度,浓度越大,密度越小,ρ4>ρ3,故答案为:ρ1>ρ2>ρ4>ρ3;
(2)表中2molL-1氨水的密度是ρ4,根据公式c=![]() 得出质量分数为:w=
得出质量分数为:w=![]() %,故答案为:
%,故答案为: ![]() %;
%;
(3)将4 mol·L-1的氨水与2 mol·L-1的硫酸等体积混合,恰好反应生成(NH4)2SO4,水解后溶液显酸性;溶液中离子浓度从大到小的顺序为c(NH4+)>c(SO42-)>c(H+)>c(OH-),故答案为:酸;c(NH4+)>c(SO42-)>c(H+)>c(OH-);
(4)硫酸的密度大于水的密度,将20%的硫酸与10%的硫酸等体积混合,所得硫酸溶液的质量分数>![]() ,即混合后质量分数大于15%,故答案为:A;
,即混合后质量分数大于15%,故答案为:A;
(5)100g浓度为4molL-1的硫酸溶液中溶质的物质的量是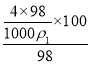 =
=![]() ,设加入水的体积是VmL,能使硫酸的物质的量浓度减小到2molL-1,则2(
,设加入水的体积是VmL,能使硫酸的物质的量浓度减小到2molL-1,则2(![]() )=
)=![]() ,解得V=
,解得V=![]() mL,故答案为:
mL,故答案为: ![]() 。
。