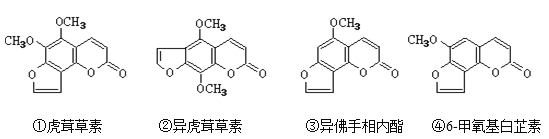
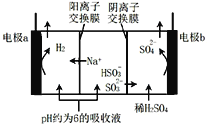
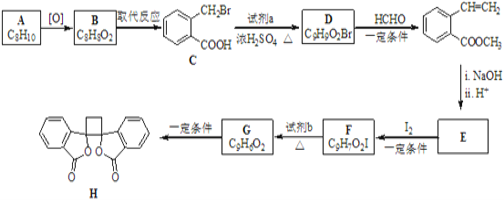
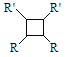
题目内容
【题目】298K时,向20ml0.1mol/L某酸HA溶液中逐滴加入0.1mol/LNaOH溶液,混合溶液的pH变化曲线如图所示。下列说法错误的是( )。
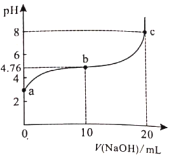
A.HA是弱酸B.b点溶液中:![]()
C.b、c之间一定存在![]() 的点D.a、b、c三点中,c点水的电离程度最大
的点D.a、b、c三点中,c点水的电离程度最大
【答案】B
【解析】
A.0.1mol/LHA溶液pH>1,故HA是弱酸,A正确;
B.b溶液显酸性,![]() ,由电荷守恒可知
,由电荷守恒可知![]() ,B错误;
,B错误;
C.溶液中存在电荷守恒:![]() ,当溶液pH=7呈中性时
,当溶液pH=7呈中性时![]() ,则
,则![]() ,所以b、c之间一定存在
,所以b、c之间一定存在![]() 的点,C正确;
的点,C正确;
D.a、b点溶液显酸性,HA电离出的![]() 对水的电离起抑制作用,c点酸碱恰好完全反应生成盐NaA,对水的电离起促进的作用,所以a、b、c三点中,c点水的电离程度最大,D正确;
对水的电离起抑制作用,c点酸碱恰好完全反应生成盐NaA,对水的电离起促进的作用,所以a、b、c三点中,c点水的电离程度最大,D正确;
故答案选B。

练习册系列答案
相关题目