题目内容
【题目】甲醇是重要的化工原料,又可作为燃料。工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) ![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-58 kJ/mol
CH3OH(g)+H2O(g) ΔH=-58 kJ/mol
③CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH=+41 kJ/mol
CO(g)+H2O(g) ΔH=+41 kJ/mol
回答下列问题:
(1)已知反应①中相关的化学键键能数据如下:
化学键 | H-H | C-O | C | H-O | C-H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | x |
则x=。
(2)若将lmol CO2和2mol H2充入容积为2L的恒容密闭容器中,在两种不同温度下发生反应②。测得CH3OH的物质的量随时间的变化如图所示。
①曲线I、Ⅱ对应的平衡常数大小关系为KIKⅡ(填“>”或“=”或“<”);
②一定温度下,能判断该反应达到化学平衡状态的是。
a.容器中压强不变 b.甲醇和水蒸气的体积比保持不变
c.v正(H2)=3v逆(CH3OH) d.2个C=O断裂的同时有6个H—H断裂
③若5min后反应达到平衡状态,H2的转化率为90%,则用CO2表示的平均反应速率为 , 该温度下的平衡常数为;若容器容积不变,下列措施可增加甲醇产率的是。
a.缩小反应容器的容积 b.使用合适的催化剂
c.充入He d.按原比例再充入CO2和H2
(3)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池。以此电池作电源,在实验室中模拟铝制品表面“钝化”处理过程(装置如图所示)。其中物质b是 , 阳极电极反应为。
【答案】
(1)413
(2)>;ac;0.06mol/(L·min);450;ad
(3)甲醇(CH3OH);2Al-6e- +3H2O=A12O3+6H+
【解析】解:(1)已知:
①CO(g)+2H2(g) ![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-58 kJ/mol
CH3OH(g)+H2O(g) ΔH=-58 kJ/mol
③CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH=+41 kJ/mol
CO(g)+H2O(g) ΔH=+41 kJ/mol
根据盖斯定律可知②一③即得到反应①的△H1=-99 kJ/mol。根据表中键能可知1076+2×436-3x-343-465=-99,解得x=413。(2)①曲线Ⅱ首先达到平衡状态,说明曲线Ⅱ的温度高于曲线Ⅰ。由于正反应是放热反应,升高温度平衡向逆反应方向进行,平衡常数减小,所以对应的平衡常数大小关系为KⅠ>KⅡ;②a.正反应体积减小,则容器中压强不变说明达到平衡状态,a正确,b根据方程式可知甲醇和水蒸气的体积比始终是1:1,不能说明达到平衡状态,b错误v正(H2)=3v逆(CH3OH)表示正逆反应速率相等,达到平衡状态,c正确,d.根据方程式可知2个C=O断裂的同时一定有6个H-H断裂,不能说明达到平衡状态,d错误,答案选ac。
③
CO2(g)+ | 3H2(g) | CH3OH(g)+ | H2O(g) | |
起始浓度(mol/L) | 0.5 | 1 | 0 | 0 |
变化浓度(mol/L) | 0.3 | 0.9 | 0.3 | 0.3 |
平衡浓度(0mol/L) | 0.2 | 0.1 | 0.3 | 0.3 |
则用CO2表示的平均反应速率为:0.3mol/L÷5min=0.06mol/(L·min);该温度下的平衡常数为0.3×0.3/0.2×0.13=450
a.正反应体积减小,缩小反应容器的容积平衡向正反应方向进行,甲醇的产率升高,a正确,
b.使用合适的催化剂平衡不移动,产率不变,b错;c容器容积不变,充入He,各物质浓度不变,平衡不移动,对产率无影响,c错误;d.按原比例再充入CO2和H2相当于增大压强,平衡向正反应方向进行,甲醇的产率升高,d正确;答案选a。(3)模拟铝制品表面“钝化”处理,则电极铝是阳极,与电源的正极相连,所以a物质是氧气,b物质是甲醇。铝为阳极,会发生氧化反应,表面形成氧化膜,必须有水参加,所以电极反应式为2Al-6e- +3H2O=A12O3+6H+
【考点精析】解答此题的关键在于理解反应热和焓变的相关知识,掌握在化学反应中放出或吸收的热量,通常叫反应热,以及对化学平衡状态本质及特征的理解,了解化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).

【题目】空气中SO2含量是重要的空气质量指标.
(1)某工厂SO2的排放量规定不得超过0.10mg/(L烟道气),为测定该工厂排放的烟道气中SO2的含量,某同学某次抽取了30.00L烟道气缓慢通过1L水,设SO2完全被吸收,设溶液体积为1L,用1.0×10﹣3mol/L的饱和碘水(密度为1g/cm3)滴定,反应为SO2+I2+2H2O═H2SO4+2HI,实验所记录数据如下:
溶有SO2的溶液体积 | 饱和碘水体积 | 指示剂 | |
第一次 | 25.00mL | 6.05 | 2~3滴淀粉 |
第二次 | 25.00mL | 7.20 | 2~3滴淀粉 |
第三次 | 25.00mL | 5.95 | 2~3滴淀粉 |
a.取25.00ml的烟道气的水溶液所用仪器名称是
b.滴定终点标志为
c.该厂排放的烟道气中SO2的含量为mg/(L烟道气)
(2)该同学在实验室还验证了SO2能否与BaCl2溶液反应的实验.二氧化硫通入氯化钡溶液中理论上不产生沉淀,但当他把SO2通入装有1mol/LBaCl2溶液的试管中后,出现了白色浑浊物.
a.该白色浑浊物为 , 产生该现象的原因可能是
b.为了避免产生沉淀,该同学设计了如下实验装置,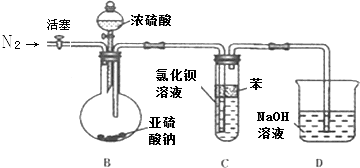
请回答下列问题
①反应开始前,先向制取SO2的装置中通入纯净的N2 , 其作用是: .
②该同学认为Ba(NO3)2溶液与BaCl2溶液一样在理论上与SO2也不会反应,请先判断正误(填“正确”、“错误”),如不正确则写出SO2与Ba(NO3)2溶液反应的化学方程式 .