题目内容
【题目】空气中SO2含量是重要的空气质量指标.
(1)某工厂SO2的排放量规定不得超过0.10mg/(L烟道气),为测定该工厂排放的烟道气中SO2的含量,某同学某次抽取了30.00L烟道气缓慢通过1L水,设SO2完全被吸收,设溶液体积为1L,用1.0×10﹣3mol/L的饱和碘水(密度为1g/cm3)滴定,反应为SO2+I2+2H2O═H2SO4+2HI,实验所记录数据如下:
溶有SO2的溶液体积 | 饱和碘水体积 | 指示剂 | |
第一次 | 25.00mL | 6.05 | 2~3滴淀粉 |
第二次 | 25.00mL | 7.20 | 2~3滴淀粉 |
第三次 | 25.00mL | 5.95 | 2~3滴淀粉 |
a.取25.00ml的烟道气的水溶液所用仪器名称是
b.滴定终点标志为
c.该厂排放的烟道气中SO2的含量为mg/(L烟道气)
(2)该同学在实验室还验证了SO2能否与BaCl2溶液反应的实验.二氧化硫通入氯化钡溶液中理论上不产生沉淀,但当他把SO2通入装有1mol/LBaCl2溶液的试管中后,出现了白色浑浊物.
a.该白色浑浊物为 , 产生该现象的原因可能是
b.为了避免产生沉淀,该同学设计了如下实验装置,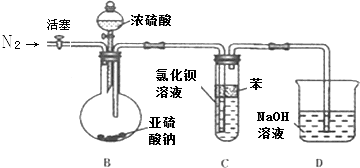
请回答下列问题
①反应开始前,先向制取SO2的装置中通入纯净的N2 , 其作用是: .
②该同学认为Ba(NO3)2溶液与BaCl2溶液一样在理论上与SO2也不会反应,请先判断正误(填“正确”、“错误”),如不正确则写出SO2与Ba(NO3)2溶液反应的化学方程式 .
【答案】
(1)酸式滴定管;滴入最后一滴试液时,溶液变为蓝色,并半分钟内不褪色;0.512
(2)BaSO4;空气和溶液中氧气把H2SO3氧化成了H2SO4 , 从而生成BaSO4;赶出装置中的气体,防止二氧化硫通入氯化钡溶液后的现象受到空气和溶液中氧气的影响;错误;Ba(NO3)2+3SO2+2H2O=BaSO4↓+2NO+2H2SO4
【解析】解:(1)a.烟道气的水溶液呈酸性,要准确量取25.00ml可以用酸式滴定管,所以答案是:酸式滴定管;b.用碘水滴定道气的水溶液,用淀粉溶液作指示剂,滴定终点标志为滴入最后一滴试液时,溶液变为蓝色,并半分钟内不褪色,所以答案是:滴入最后一滴试液时,溶液变为蓝色,并半分钟内不褪色;c.根据表中的数据可知,第二组数据偏差较大,应去掉,所以反应用掉的碘的物质的量为1.0×10﹣3mol/L× ![]() ×10﹣3L=6.0×10﹣6mol,根据方程式SO2+I2+2H2O═H2SO4+2HI,可知SO2的物质的量为6.0×10﹣6mol,所以25mL溶有SO2的溶液中SO2的含量为
×10﹣3L=6.0×10﹣6mol,根据方程式SO2+I2+2H2O═H2SO4+2HI,可知SO2的物质的量为6.0×10﹣6mol,所以25mL溶有SO2的溶液中SO2的含量为 ![]() =15.36mg/L,所以排放的烟道气中SO2的含量为
=15.36mg/L,所以排放的烟道气中SO2的含量为 ![]() =0.512mg/(L烟道气)所以答案是:0.512;(2)a.二氧化硫与水反应生成亚硫酸,亚硫酸能被空气中的氧气或溶液中的氧气氧化成硫酸,能与氯化钡反应生成硫酸钡,所以白色沉淀为BaSO4 , 所以答案是:BaSO4;空气和溶液中氧气把H2SO3氧化成了H2SO4 , 从而生成BaSO4;b.①为了避免二氧化硫溶于水而被氧化产生沉淀,应将装置中的空气排尽,所以要通纯净的氮气,防止二氧化硫通入氯化钡溶液后的现象受到空气和溶液中氧气的影响,所以答案是:赶出装置中的气体,防止二氧化硫通入氯化钡溶液后的现象受到空气和溶液中氧气的影响;②二氧化硫的水溶液呈酸性,所以将二氧化硫通入硝酸钡溶液中,二氧化硫能被硝酸根氧化成硫酸根离子,而产生硫酸钡沉淀,所以该同学判断错误,反应的方程式为Ba(NO3)2+3SO2+2H2O=BaSO4↓+2NO+2H2SO4 , 所以答案是:错误;Ba(NO3)2+3SO2+2H2O=BaSO4↓+2NO+2H2SO4 .
=0.512mg/(L烟道气)所以答案是:0.512;(2)a.二氧化硫与水反应生成亚硫酸,亚硫酸能被空气中的氧气或溶液中的氧气氧化成硫酸,能与氯化钡反应生成硫酸钡,所以白色沉淀为BaSO4 , 所以答案是:BaSO4;空气和溶液中氧气把H2SO3氧化成了H2SO4 , 从而生成BaSO4;b.①为了避免二氧化硫溶于水而被氧化产生沉淀,应将装置中的空气排尽,所以要通纯净的氮气,防止二氧化硫通入氯化钡溶液后的现象受到空气和溶液中氧气的影响,所以答案是:赶出装置中的气体,防止二氧化硫通入氯化钡溶液后的现象受到空气和溶液中氧气的影响;②二氧化硫的水溶液呈酸性,所以将二氧化硫通入硝酸钡溶液中,二氧化硫能被硝酸根氧化成硫酸根离子,而产生硫酸钡沉淀,所以该同学判断错误,反应的方程式为Ba(NO3)2+3SO2+2H2O=BaSO4↓+2NO+2H2SO4 , 所以答案是:错误;Ba(NO3)2+3SO2+2H2O=BaSO4↓+2NO+2H2SO4 .