题目内容
【题目】根据题意填空
(1)0.5molH2SO4的质量是;
(2)标准状况下,1.92g某气体的体积为672mL,则该气体的摩尔质量为;
(3)等质量的SO2和SO3的物质的量之比;氧原子个数比为;
(4)11.1gCaCl2固体溶于水配成500mL溶液,其浓度为molL﹣1 , 从中取出100mL溶液,其中Cl﹣的物质的量为mol;再把取出的溶液加水稀释成500mL,则此时CaCl2溶液的浓度为molL﹣1 .
【答案】
(1)49g
(2)64g/mol
(3)5:4;5:6
(4)0.2;0.02;0.04
【解析】解:(1)0.5molH2SO4的质量:0.5mol×98g/mol=49g,所以答案是:49g;(2)标准状况下,1.92g某气体的体积为672mL,物质的量为 ![]() =0.03mol,其摩尔质量=
=0.03mol,其摩尔质量= ![]() =64g/mol,所以答案是:64g/mol;(3)依据m=nM可知,质量一定时,物质的量与摩尔质量成反比,所以质量相等的SO2和SO3物质的量之比等于80:64=5:4;含有氧原子个数之比5×2:4×3=5:6;
=64g/mol,所以答案是:64g/mol;(3)依据m=nM可知,质量一定时,物质的量与摩尔质量成反比,所以质量相等的SO2和SO3物质的量之比等于80:64=5:4;含有氧原子个数之比5×2:4×3=5:6;
所以答案是:5:4;5:6;(4)11.1gCaCl2固体溶于水配成500mL溶液,物质的量浓度C= ![]() =
= ![]() =0.2mol/L;氯化钠为强电解质,所以C(NaCl)=C(Cl﹣)=0.2mol/L,取出100mL溶液,其中Cl﹣的物质的量=0.2mol/L×0.1L=0.02mol;
=0.2mol/L;氯化钠为强电解质,所以C(NaCl)=C(Cl﹣)=0.2mol/L,取出100mL溶液,其中Cl﹣的物质的量=0.2mol/L×0.1L=0.02mol;
设稀释后溶液浓度为C′,则依据溶液稀释过程中溶质的物质的量不变得:0.02mol=0.5L×C′,解得C′=0.04mol/L;
所以答案是:0.2;0.02;0.04.

【题目】现应用酸碱中和滴定法测定某市售白醋的含酸量.
Ⅰ.实验步骤
(1)用___________(填仪器名称)量取10.00 mL食用白醋,在烧杯中用水稀释后转移到100 mL________(填仪器名称)中定容,摇匀即得待测白醋溶液.
(2)取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴_________作指示剂.
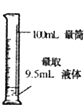
(3)读取盛装0.1000 molL﹣1 NaOH 溶液的碱式滴定管的初始读数.如果液面位置如右图所示,则此时的读数为_______mL.
![]()
(4)滴定.滴定过程中,眼睛应注视__________________________; 当滴至____________________________________时停止滴定,并记录NaOH溶液的终读数.重复滴定4次.
Ⅱ.实验记录
实验序号 | 待测白醋溶液体积/mL | 0.1000mol·L-1 NaOH溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 20.00 | 0.10 | 15.10 |
2 | 20.00 | 0.00 | 14.95 |
3 | 20.00 | 0.15 | 15.20 |
4 | 20.00 | 1.10 | 17.10 |
Ⅲ.数据处理与讨论
(1)按实验所得数据,可折算得c(市售白醋)=________molL-1.
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是___填写序号)
a.碱式滴定管在装液前未用标准NaOH溶液润洗.
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失.
c.锥形瓶中加入待测白醋溶液后,再加少量水.
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出.