题目内容
20.下列溶液中的离子一定能大量共存的是( )| A. | 能使酚酞变红色的溶液中:Na+,K+,OH-,S2O${\;}_{3}^{2-}$ | |
| B. | 在加入铝粉能产生氢气的溶液中:NH${\;}_{4}^{+}$,Fe2+,SO${\;}_{4}^{2-}$,NO${\;}_{3}^{-}$ | |
| C. | 室温下由水电离出的氢离子浓度c(H+)=1×10-14mol/L的溶液中:Ba2+,NO${\;}_{3}^{-}$,K+,F- | |
| D. | 含大量Cu2+的溶液中:NH${\;}_{4}^{+}$,Na+,Cl-,HS- |
分析 A.能使酚酞变红色的溶液,显碱性;
B.加入铝粉能产生氢气的溶液,为非氧化性酸或强碱溶液;
C.室温下由水电离出的氢离子浓度c(H+)=1×10-14mol/L的溶液,为酸或碱溶液;
D.Cu2+与HS-反应生成CuS沉淀.
解答 解:A.能使酚酞变红色的溶液,显碱性,该组离子之间不反应,可大量共存,故A正确;
B.加入铝粉能产生氢气的溶液,为非氧化性酸或强碱溶液,碱性溶液中不能大量存在NH4+、Fe2+,酸溶液中NO3-、Fe2+(或Al)发生氧化还原反应不生成氢气,不能大量共存,故B错误;
C.室温下由水电离出的氢离子浓度c(H+)=1×10-14mol/L的溶液,为酸或碱溶液,酸溶液中不能大量存在F-,故C错误;
D.Cu2+与HS-反应生成CuS沉淀,不能大量共存,故D错误;
故选A.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
14.关于容量瓶的四种叙述:①是配制准确浓度溶液的仪器;②可以贮存溶液;③使用之前要检查是否漏水;④能用来加热.这些叙述中正确的是 ( )
| A. | ①②③④ | B. | ②③ | C. | ①③ | D. | ②③④ |
11.下列有关化学用语的表示正确的是( )
| A. | 甲烷分子的球棍模型: | |
| B. | HClO的结构式:H-Cl-O | |
| C. | 质子数为53,中子数为78的碘原子:${\;}_{53}^{131}$I | |
| D. | 熔融状态下硫酸氢钾的电离方程式:KHSO4$\frac{\underline{\;熔融\;}}{\;}$ K++H++SO42- |
15.下列说法不正确的是( )
| A. | 光催化还原水制氢比电解水制氢更节能环保、更经济 | |
| B. | 氨氮废水(含NH4+及NH3)可用化学氧化法或电化学氧化法处理 | |
| C. | 某光学检测技术具有极高的灵敏度,可检测到单个细胞(V=10-12L)内的数个目标分子,据此可推算该检测技术能测量到细胞内浓度约为10-12~10-11mol•L-1的目标分子 | |
| D. | 油脂、淀粉、蔗糖和葡萄糖在一定条件都能发生水解反应 |
5.反应2SO2+O2?2SO3在一定条件下反应一段时间后,SO3的浓度增加了0.8mol/L,在这段时间内用O2表示的反应速率为0.1mol•L-1•s-1,则这段反应时间为( )
| A. | 2.5s | B. | 4s | C. | 5s | D. | 10s |
12.设阿伏加德罗常数约为NA,下列叙述中正确的是( )
| A. | 标准状况下,22.4 L CO2和CO混合气体中含有的氧原子数为NA | |
| B. | 1mol Fe在过量的 C12中充分燃烧,转移的电子数为2NA | |
| C. | 0.1mol CH4所含的电子数为NA | |
| D. | 1 L lmol•L-1的Na2C03溶液中离子总数为3NA |
9.某有机物的结构简式为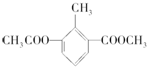 ,关于该物质的叙述错误的是( )
,关于该物质的叙述错误的是( )
 ,关于该物质的叙述错误的是( )
,关于该物质的叙述错误的是( )| A. | 一分子该物质中含有12个H原子 | |
| B. | 该物质的一氯代物有4种 | |
| C. | 该物质能使酸性KMnO4溶液褪色 | |
| D. | 1 mol该物质分别与足量H2、NaOH溶液反应,消耗H2、NaOH的物质的量均为3mol |
 CH3Cl为无色,略带臭味的气体,密度为2.25g/L,熔点为-24.2℃,20℃时在水中的溶解度为400mL,易溶于乙醇和丙醇等有机溶剂.
CH3Cl为无色,略带臭味的气体,密度为2.25g/L,熔点为-24.2℃,20℃时在水中的溶解度为400mL,易溶于乙醇和丙醇等有机溶剂.