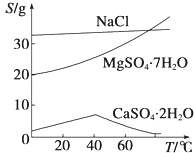
题目内容
【题目】常温下有浓度均为0.1molL﹣1的三种溶液:①Na2CO3、②NaHCO3、③HCl
(1)溶液②中按物质的量浓度由大到小顺序排列该溶液中各离子浓度;
(2)溶液②中,c(CO32﹣)+c(HCO3﹣)+c(H2CO3)= molL﹣1;
(3)将10mL溶液③加水稀释至100mL,则此时溶液中由水电离出的c( H+)=molL﹣1 .
【答案】
(1)c(Na+)>c(HCO3﹣)>c(OH﹣)>c(H+)>c(CO32﹣)
(2)0.1
(3)10﹣12
【解析】解:(1)碳酸氢钠溶液中碳酸氢根离子的水解程度大于电离程度,显示碱性,即c(Na+)>c(HCO3﹣)>c(OH﹣)>c(H+)>c(CO32﹣),所以答案是:c(Na+)>c(HCO3﹣)>c(OH﹣)>c(H+)>c(CO32﹣);
(2.)溶液②NaHCO3中存在物料守恒,溶液中碳元素所有存在形式浓度总和等于钠离子浓度,得到c(CO32﹣)+c(HCO3﹣)+c(H2CO3)=c(Na+)=0.1mol/L,
所以答案是:0.1;
(3.)取10mL溶液③,加水稀释到100mL,溶液浓度为原来的 ![]() ,为0.01mol/L,由Kw=c(OH﹣)c(H+)可知,c(OH﹣)=10﹣12 molL﹣1 , 则此时溶液中由水电离出的c(H+)=10﹣12 molL﹣1 ,
,为0.01mol/L,由Kw=c(OH﹣)c(H+)可知,c(OH﹣)=10﹣12 molL﹣1 , 则此时溶液中由水电离出的c(H+)=10﹣12 molL﹣1 ,
所以答案是:10﹣12 .

练习册系列答案
相关题目