��Ŀ����
����Ŀ���������ȼҵ�еķ�������Ҫ�ɷ���þ�Ĺ����κ�̼���Σ����������������Ƶ��Σ���ʵ����������Ϊԭ����ȡMgSO47H2O��ʵ��������£� 29.0g���� ![]()
![]() ��Һ�����Һ�����Ʒ
��Һ�����Һ�����Ʒ
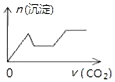
��֪����������Ksp[Mg��OH��2]=6.0��10��12 �� ������Һ�У�Fe2+��Fe3+��Al3+�ӿ�ʼ������������ȫ��pH��Χ����Ϊ7.1��9.6��2.0��3.7��3.1��4.7�������ֻ�������ܽ�ȣ�S�����¶ȱ仯��������ͼ��ʾ��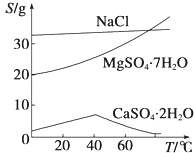
��1���������м���ϡ�����pHΪ1��2�Լ���е�Ŀ������
��2���������µ���Һ��Mg2+��Ũ��Ϊ6.0molL��1 �� ����ҺpH���ſ��ܲ���Mg��OH��2������
��3������Һ����Һ�����ȼ���NaClO����ҺpHԼΪ5���ٳ��ȹ��ˣ�����ȹ��˵�Ŀ���� �� ��������Ҫ�ɷ�����
��4������Һ���л��MgSO47H2O�����ʵ�鲽������Ϊ������Һ���м����� �ڹ��ˣ��ó���������������Ũ�������½ᾧ���ݹ��ˡ�ϴ�ӵò�Ʒ��
��5������õ�MgSO47H2O������Ϊ24.6g�����������þ[��Mg��OH��2��]�İٷֺ���ԼΪ��MgSO47H2O����Է�������Ϊ246����
���𰸡�
��1��Ϊ�����Mg2+�Ľ�ȡ��
��2��8
��3���¶Ƚϸ�ʱ������þ�η���ø����������CaSO4?2H2O�ܽ��С��Al��OH��3��Fe��OH��3��CaSO4?2H2O
��4��NaOH��Һ��������м�����ϡ����
��5��20.0%
����������1������������ȫ������pHֵ����֪�����������м���ϡ�����pHΪ1��2����е�Ŀ����Ϊ�����Mg2+�Ľ�ȡ�ʣ� ���Դ��ǣ�Ϊ�����Mg2+�Ľ�ȡ�ʣ���2��������þ��Ksp=c��Mg2+��c��OH����2 �� ��Һ��Mg2+��Ũ��Ϊ6.0molL��1 �� ����Һ��c��OH����= ![]() =10��6mol/L������������Ũ��Ϊ10��8mol/L��pHΪ8�����Դ��ǣ�8����3���¶Ƚϸ�ʱ������þ�η���ø����ף����߸������ֻ�������ܽ�ȣ�S�����¶ȱ仯�����ߣ�����֪��������CaSO42H2O�ܽ��С�����õ���������Ҫ�ɷ��ǣ�Al��OH��3��Fe��OH��3��CaSO42H2O��
=10��6mol/L������������Ũ��Ϊ10��8mol/L��pHΪ8�����Դ��ǣ�8����3���¶Ƚϸ�ʱ������þ�η���ø����ף����߸������ֻ�������ܽ�ȣ�S�����¶ȱ仯�����ߣ�����֪��������CaSO42H2O�ܽ��С�����õ���������Ҫ�ɷ��ǣ�Al��OH��3��Fe��OH��3��CaSO42H2O��
���Դ��ǣ��¶Ƚϸ�ʱ������þ�η���ø����������CaSO42H2O�ܽ��С�ȣ�Al��OH��3��Fe��OH��3��CaSO42H2O����4��þ���ӿ��Ժ��������Ʒ�����Ӧ����������þ���������ˣ��õ������ij������ټ������ᣬ�����ᾧ���Ի������þ���壬
���Դ��ǣ�NaOH��Һ��������м�����ϡ�����5����������к�Mg��OH��2������ΪX��MgSO47H2O����Ϊ24.6�ˣ����ʵ�����0.1mol���ɹ�ϵʽMgSO47H2O��Mg��OH��2��֪��Mg��OH��2������Ϊ0.1mol��58g/mol=5.8g���ʸ������к�Mg��OH��2�İٷֺ���Ϊ ![]() ��100%=20.0%��
��100%=20.0%��
���Դ��ǣ�20.0%��

 ÿ�α���ϵ�д�
ÿ�α���ϵ�д� ��ѧ����ϵ�д�
��ѧ����ϵ�д�