题目内容
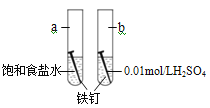
【题目】(1)铁钉在氯气中被锈蚀为棕褐色物质FeCl3,而在盐酸中生成浅绿色的FeCl2溶液。在Cl2、Cl-、H+中,具有氧化性的是____________,其中氧化性最强的是____________。
(2)盐酸在不同的反应中可以分别表现出酸性、氧化性和还原性。现在有如下三个反应,请写出盐酸在三个反应中分别起何种作用:
①Zn+2HCl===ZnCl2+H2↑____________________;
②NaOH+HCl===NaCl+H2O__________________;
③2HCl![]() H2↑+Cl2↑________________________。
H2↑+Cl2↑________________________。
(3)铁钉在氯气中被锈蚀成棕褐色物质FeCl3,而在盐酸中生成浅绿色溶液(FeCl2);向浓盐酸中滴加KMnO4溶液产生淡黄绿色气体(Cl2)。在Cl2、H+、![]() 中,__________________氧化性最强。
中,__________________氧化性最强。
(4)高锰酸钾与氢溴酸溶液可以发生下列反应:2KMnO4+16HBr===5Br2+2MnBr2+2KBr+8H2O。其中还原剂是________________。若消耗15.8 g氧化剂,则被氧化的还原剂的质量是______________g。HBr的作用是____________________。
【答案】Cl2、H+ Cl2 氧化性、酸性 酸性 既有氧化性又有还原性 MnO4- HBr 40.5 还原性、酸性
【解析】
(1)根据元素的化合价和物质的性质分析;
(2)①Zn+2HCl=ZnCl2+H2↑中,HCl中H元素的化合价降低;
②NaOH+HCl=NaCl+H2O中,没有元素的化合价变化,为中和反应;
③2HCl![]() H2↑+Cl2↑中,H元素的化合价降低,Cl元素的化合价升高;
H2↑+Cl2↑中,H元素的化合价降低,Cl元素的化合价升高;
(3)同一氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性;
(4)反应2KMnO4+16HBr═5Br2+2MnBr2+2KBr+8H2O中,Br元素化合价升高,Mn元素化合价降低,则反应中KMnO4为氧化剂,HBr为还原剂,根据方程式计算。
(1)在Cl2、Cl-、H+中,氢元素处于最高价具有氧化性,氯气容易得电子具有较强的氧化性,所以具有氧化性的是Cl2、H+,其中氧化性最强的是Cl2,故答案为:Cl2、H+;Cl2;
(2)①Zn+2HCl=ZnCl2+H2↑中,HCl中H元素的化合价降低,则体现其氧化性,反应中生成盐,还表现酸性,故答案为:氧化性、酸性;
②NaOH+HCl=NaCl+H2O中,没有元素的化合价变化,为中和反应,反应生成盐,表现酸性;故答案为:酸性;
③2HCl![]() H2↑+Cl2↑,H元素的化合价降低,Cl元素的化合价升高,所以HCl表现了氧化性、还原性,故答案为:既有氧化性又有还原性;
H2↑+Cl2↑,H元素的化合价降低,Cl元素的化合价升高,所以HCl表现了氧化性、还原性,故答案为:既有氧化性又有还原性;
(3)铁钉在氯气中被锈蚀成棕褐色物质(FeCl3),Cl2表现氧化性,而在盐酸中生成浅绿色溶液(FeCl2),H+具有氧化性,且氧化性Cl2>H+;浓盐酸中滴加KMnO4溶液产生黄绿色气体(Cl2),则证明氧化性是MnO4->Cl2,所以氧化性顺序是:MnO4->Cl2>H+,所以氧化性最强的是MnO4-,故答案为:MnO4-
(4)反应2KMnO4+16HBr═5Br2+2MnBr2+2KBr+8H2O中,Br元素化合价升高,Mn元素化合价降低,则反应中KMnO4为氧化剂,HBr为还原剂,且做还原剂的只占参加反应的HBr的![]() ;
;
设:消耗15.8 g氧化剂,则被氧化的还原剂的质量是x
2KMnO4 +16HBr═5Br2+2MnBr2+2KBr+8H2O
158×2 81×16×![]()
15.8g x 解得:x=![]() =40.5g
=40.5g
反应中HBr被氧化为Br2,HBr表现还原性;有MnBr2、KBr(盐)生成,HBr表现出了酸性;
故答案为:HBr;40.5;还原性、酸性。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案【题目】FeCl2是一种常用的还原剂、媒染剂。某化学小组同学在实验室里用如下两种方法来制备无水FeCl2。有关物质的性质如下:
C6H5Cl(氯苯) | C6H4Cl2(二氯苯) | FeCl3 | FeCl2 | |
溶解性 | 不溶于水,易溶于苯、乙醇 | 不溶于C6H5Cl、C6H4Cl2、苯,易溶于乙醇,易吸水 | ||
熔点/℃ | -45 | 53 | 易升华 | |
沸点/℃ | 132 | 173 | - | - |

请回答下列问题:
(1)利用反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl制取无水FeCl2并测定FeCl3的转化率。按上图装置,在三颈烧瓶中放入32.5g无水氯化铁和过量的氯苯。打开K1、K2,关闭K3,通一段时间H2后关闭K2,控制三颈烧瓶内反应温度在128-139℃,反应一段时间。反应完成后打开K2再通氢气一段时间。
①仪器a的名称是______,装置B中盛装的试剂是______。
②反应后再通入H2的目的是______。
③冷却实验装置,将三颈烧瓶内物质倒出,经过滤、用苯洗涤、干燥后,得到粗产品,回收滤液中C6H5Cl的操作方法是______。
④反应后将锥形瓶中溶液配成250mL溶液,取25.00mL所配溶液,用0.4molL-1NaOH溶液滴定,消耗NaOH溶液23.60mL,则氯化铁的转化率为______。
(2)打开K1、K3,关闭K2,通氢气与氯化铁反应制取无水FeCl2。
①写出反应的化学方程式______。
②实验制得FeCl2后并防止氧化的操作是______。
③请指出该制备方法的缺点______。