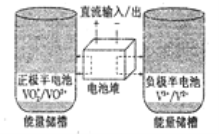
��Ŀ����
����Ŀ����������Դ�ı��⣬�̲��ŷḻ�Ļ�ѧԪ�أ����ȡ��塢��ȡ�
��1����ԭ�ӵĽṹʾ��ͼ_____����ҵ�����õ�ⱥ��ʳ��ˮ������������仯ѧ����ʽΪ_____��
��2��������ͨ��ʯ�����п���ȡƯ�ۣ���ѧ����ʽΪ_____��Ư������ˮ�Ϳ����еĶ�����̼���ã����õ���Һ������Ư�������������ɵ� HClO��������Һ��ʱ������ֻ�ʧȥƯ�����������漰�Ļ�ѧ��Ӧ����ʽΪ_____��
��3����ʢ�� KI ��Һ���Թ��м������� CCl4��μ���ˮ��CCl4������ɫ������������Թ��еμ���ˮ����CCl4 �����dz���������ɫ��
���������գ�
��a��д������ƽ CCl4������ɫ�����ɫ�Ļ�ѧ��Ӧ����ʽ�����������������������ת�Ƶķ������Ŀ��_____________
_____+_____+_____��_____HIO3+_____�÷�Ӧ�У�_____Ԫ�صĻ��ϼ����ߡ�
��b���� KI ���� KBr���� CCl4���Ϊ_____ɫ�������μ���ˮ��CCl4 �����ɫû�б仯��Cl2��HIO3��HBrO3��������ǿ������˳����_____��
��c���ӵ����к�����Ϊ 20mg��50mg/kg����ȡ�ӵ��Σ��� KIO3 ��ʳ�Σ�1000kg���� KI �� Cl2 ��Ӧ֮ KIO3��������Ҫ���� Cl2_____mol������ 2 λС������
���𰸡� 2NaCl+2H2O
2NaCl+2H2O![]() Cl2��+H2��+2NaOH 2Ca(
Cl2��+H2��+2NaOH 2Ca(
OH)
2+2Cl2��Ca(
ClO)2+CaCl2+2H2O Ca(
ClO)
2+CO2+H2O��CaCO3��+2HClO��2HClO![]() 2HCl+O2��
2HCl+O2�� ![]() 5Cl2 I2 6H2O 2 10HCl I ���� HBrO3��Cl2��HIO3 0.47
5Cl2 I2 6H2O 2 10HCl I ���� HBrO3��Cl2��HIO3 0.47
��������
��1����ԭ�ӵĺ��������Ϊ17�������Ϊ7�����ӣ�����ȷ��ԭ�ӽṹʾ��ͼΪ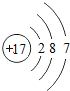 ����ҵ�����õ�ⱥ��ʳ��ˮ������������仯ѧ����ʽΪ2NaCl+2H2O
����ҵ�����õ�ⱥ��ʳ��ˮ������������仯ѧ����ʽΪ2NaCl+2H2O![]() Cl2��+H2��+2NaOH��
Cl2��+H2��+2NaOH��
�ʴ�Ϊ��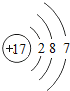 ��2NaCl+2H2O
��2NaCl+2H2O![]() Cl2��+H2��+2NaOH��
Cl2��+H2��+2NaOH��
��2���������������Ʒ�Ӧ�����Ȼ��ơ�������ƺ�ˮ����Ӧ�Ļ�ѧ����ʽ��2Ca(
OH)
2+2Cl2��Ca(
ClO)2+CaCl2+2H2O�����������Ա�̼������Ca(ClO)2������е�CO2��Ӧ����HClO��CaCO3��������Ӧ�ķ���ʽΪCa(
ClO)
2+CO2+H2O��CaCO3��+2HClO��������Ư�ס�ɱ�����õĴ����ᣬ����Һ������Ư���������������ɵ�HClO�������ԣ�HClO�����ֽ⣬��ʧȥƯ���������ֽ�ķ���ʽΪ��2HClO![]() 2HCl+O2����
2HCl+O2����
�ʴ�Ϊ��2Ca(
OH)
2+2Cl2��Ca(ClO)2+CaCl2+2H2O��Ca(
ClO)2+CO2+H2O��CaCO3��+2HClO��2HClO![]() 2HCl+O2����
2HCl+O2����
��3��a����������ǿ�����ԣ���ʢ��KI��Һ���Թ��м�������CCl4��μ���ˮ��CCl4������ɫ��˵������I2���������Թ��еμ���ˮ����CCl4�����dz���������ɫ��˵��I2����һ������������HIO3��ͬʱ��������ԭΪHCl����Ӧ�ķ���ʽΪ��5Cl2+I2+6H2O��2HIO3+10HCl����Ӧ��IԪ�صĻ��ϼ����ߣ��������������������ת�Ƶķ������ĿΪ![]() ��
��
�ʴ�Ϊ��![]() ��5Cl2��I2��6H2O��2��10HCl��I��
��5Cl2��I2��6H2O��2��10HCl��I��
b��KI����KBrʱ���õ������嵥�ʣ�������CCl4�гʺ���ɫ�������μ���ˮʱ����ɫ���䣬��֪��ˮ���ܽ��嵥��������HBrO3����������ǿ��˳��Ϊ��HBrO3��Cl2��HIO3��
�ʴ�Ϊ�����أ�HBrO3��Cl2��HIO3��
c.1000kg�ӵ�ʳ���к���20g��KI+3Cl2+3H2O��KIO3+6HCl������KIO3��I��KI��3Cl2��֪������Ҫ����Cl2�����ʵ�����![]() ��3��0.47mol��
��3��0.47mol��
�ʴ�Ϊ��0.47��