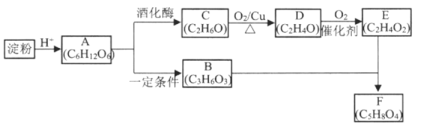
题目内容
【题目】有3.2g CuO、Fe2O3 混合物跟足量CO充分反应后固体减少了0.72g,反应后全部气体用50mL 0.7mol·L-1 Ba(OH)2溶液吸收。下列有关叙述中正确的是
A.反应中生成的CO2体积为1.008 L
B.吸收CO2后的溶液中一定不含Ba(HCO3)2
C.原混合物中CuO与Fe2O3 质量比为3:1
D.若将质量相同的混合物加过量硫酸溶解后,再加入100mLNaOH溶液时沉淀达最大量,由此可求得c(NaOH)= 0.75 mol·L-1
【答案】C
【解析】
A.CuO、Fe2O3混合物跟足量CO充分反应,固体减少质量为混合物中含有的氧元素的质量,CO分子获得1个O原子形成CO2分子,故![]() ,故标况下二氧化碳的体积=0.045mol×22.4L/mol=1.008L,但题干未告知是在标准状况下,二氧化碳的气体摩尔体积不一定为22.4L/mol,A错误;
,故标况下二氧化碳的体积=0.045mol×22.4L/mol=1.008L,但题干未告知是在标准状况下,二氧化碳的气体摩尔体积不一定为22.4L/mol,A错误;
B.n[Ba(OH)2]=0.7mol/L×0.05L=0.035mol,故n(CO2):n[Ba(OH)2]=0.045mol:0.035mol=9:7,介于1:1与2:1之间,故生成碳酸钡与碳酸氢钡, B错误;
C.CuO、Fe2O3混合物跟足量CO充分反应,固体减少质量为混合物中含有的氧元素的质量,混合物中氧原子的物质的量为0.045mol,令混合物中CuO、Fe2O3的物质的量分别为xmol、ymol,根据二者质量之和列方程为:80x+160y=3.2g①,根据氧原子的物质的量之和列方程为x+3y=0.045mol②,联合解①②方程组可得x=0.03mol y=0.005mol,故m(CuO)=0.03mol×80g/mol=2.4g,m(Fe2O3)=0.005mol×160g/mol=0.80g,故二者质量比为3:1, C正确;
D.由于硫酸过量,不能确定NaOH的物质的量,不能确定氢氧化钠的物质的量浓度,D错误;
故答案为:C。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案【题目】补充完成下表:(请把序号①~⑦的答案填在相应的位置上)
元素 | 甲 | 乙 | 丙 |
元素符号 | ①______ | ②______ | O |
原子结构示意图 |
| ③______ | ④______ |
周期 | 三 | 三 | ⑤______ |
族 | ⑥______ | ⅦA | ⑦______ |