题目内容
【题目】汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+l6N2↑。若氧化产物比还原产物多1.4mol,则下列判断正确的是( )
A.生成42.0LN2(标准状况)
B.有0.2molKNO3被氧化
C.转移电子的物质的量为1mol
D.被氧化的N原子的物质的量为1mol
【答案】C
【解析】
根据反应方程式:10NaN3+2KNO3=K2O+5Na2O+l6N2↑可知氧化产物、还原产物均为N2,16molN2中,有15mol是氧化产物,1mol是还原产物,故氧化产物比还原产物多14mol,转移的电子数是10mol,故氧化产物比还原产物多1.4mol,生成的N2是1.6mol,体积为![]() ,故A错误;消耗的KNO3为0.2mol,但是KNO3中的N元素化合价降,是被还原,故B错误;转移的电子数是 1mol,故C正确;被氧化的N原子时NaN3中的N原子为3mol,故D错误;故答案为:C。
,故A错误;消耗的KNO3为0.2mol,但是KNO3中的N元素化合价降,是被还原,故B错误;转移的电子数是 1mol,故C正确;被氧化的N原子时NaN3中的N原子为3mol,故D错误;故答案为:C。

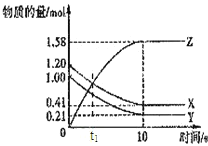
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g) ![]() 2Z(g) ΔH< 0,一段时间后达到平衡,反应过程中测定的数据如表:下列说法正确的是( )
2Z(g) ΔH< 0,一段时间后达到平衡,反应过程中测定的数据如表:下列说法正确的是( )
t/min | 2 | 4 | 7 | 9 |
n(Y)mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前2min的平均速率v(Z)=2.0×10-3 mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v正)
C.其他条件不变,向平衡体系中再充入0.16mol气体X,与原平衡相比,达到新平衡时,气体Y的转化率增大,X的体积分数增大,Z的体积分数减少
D.保持其他条件不变,起始时向容器中充入0.32mol气体X和0.32mol气体Y,到达平衡时,n(Z)<0.24mol
【题目】下列实验操作、现象和结论均正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 向Na2SO4溶液中先加硝酸酸化,再加BaCl2溶液 | 无明显现象 | 不能用硝酸和BaCl2溶液检验SO |
B | 向AlCl3溶液中滴加过量氨水 | 溶液澄清 | AlCl3与NH3·H2O能大量共存 |
C | 将可调高度的铜丝伸入到稀HNO3中 | 溶液变蓝 | Cu与稀HNO3发生置换反应 |
D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,震荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
A.AB.BC.CD.D