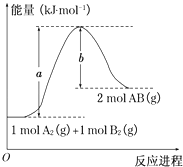
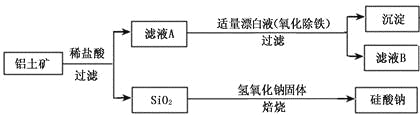
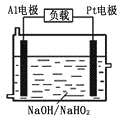
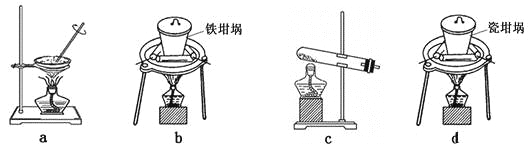
题目内容
【题目】下列实验操作、现象和结论均正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 向Na2SO4溶液中先加硝酸酸化,再加BaCl2溶液 | 无明显现象 | 不能用硝酸和BaCl2溶液检验SO |
B | 向AlCl3溶液中滴加过量氨水 | 溶液澄清 | AlCl3与NH3·H2O能大量共存 |
C | 将可调高度的铜丝伸入到稀HNO3中 | 溶液变蓝 | Cu与稀HNO3发生置换反应 |
D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,震荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
A.AB.BC.CD.D
【答案】D
【解析】
A.向Na2SO4溶液中先加硝酸酸化,再加BaCl2溶液,有白色沉淀生成,因为硫酸钠溶液中没有还原性的离子,可用硝酸酸化,故A错误;
B.向AlCl3溶液中滴加过量氨水,只生成Al(OH)3白色沉淀,沉淀不会溶解,则AlCl3与NH3·H2O不能大量共存,故B错误;
C.Cu与稀HNO3反应生成硝酸铜、NO和水,溶液变蓝色,但不是置换反应,故C错误;
D.将KI和FeCl3溶液在试管中混合后,加入CCl4,震荡,静置,可观察到下层溶液显紫红色,说明有I2生成,可知氧化性:Fe3+>I2,故D正确;
故答案为D。

【题目】下表中离子方程式及其评价均合理的是( )
选项 | 化学反应及离子方程式 | 评价 |
A | 氧化亚铁溶于稀硝酸FeO+2H+=Fe2++H2O | 碱性氧化物与酸反应生成盐和水,正确 |
B | 向亚硫酸铵溶液中加少量氢氧化钡溶液Ba2++SO | 复分解反应,有沉淀生成,正确 |
C | 含nmolFeBr2的溶液中通入nmolCl2完全反应:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | 氧化还原反应离子方程式满足元素守恒、电子守恒、电荷守恒,正确 |
D | 氯化铁溶液中滴入硫氰化钾溶液:Fe3++3SCN-=Fe(SCN)3 | 复分解反应,无气体生成,无沉淀生成,不正确 |
A.AB.BC.CD.D