题目内容
下列各表述与示意图一致的是

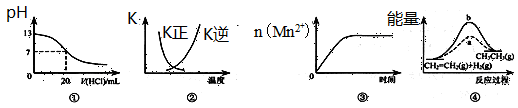

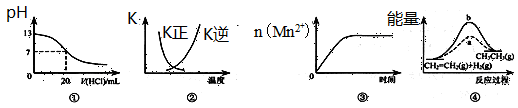
| A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化 |
B.图②中曲线表示反应2SO2(g) + O2(g) 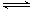 2SO3(g);ΔH<0 正、逆反应的平衡常数K随温度的变化 2SO3(g);ΔH<0 正、逆反应的平衡常数K随温度的变化 |
| C.图③表示10 mL 0.01 mol·L-1 KMnO4酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化 |
| D.图④中a、b曲线分别表示反应CH2=CH2 (g) + H2(g)→CH3CH3(g);ΔH<0使用和未使用催化剂时,反应过程中的能量变化 |
B
试题分析:根据图象中纵横坐标的含义,利用点、线来分析一个量发生变化随另外一个量如何变化,若变化趋势与图象中变化趋势一致,即为正确答案。A、0.1mol?L-1NaOH溶液的pH为13,用0.1mol?L-1盐酸滴定恰好中和时pH为7,由于浓度相同,则体积相同。但酸碱中和在接近终点时,pH会发生突变,曲线的斜率会很大,故A错误;B、由于反应为放热反应,则升高温度,平衡逆向移动。所以平衡后升高温度K逆减小,而K正增大,且正逆反应的平衡常数互为倒数关系,故B正确;C、由于反应中生成的Mn2+对该反应能起催化剂的作用,从而使反应速率加快,因此与图像不符,C不正确;D、由于该反应是放热反应,所以反应物的总能量高于生成物的总能量,但图象描述的反应物的总能量低于生成物的总能量,因此D错误,答案选B。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
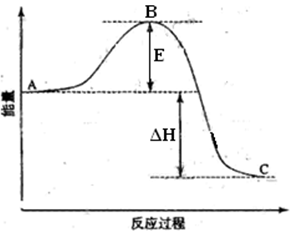
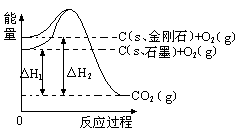






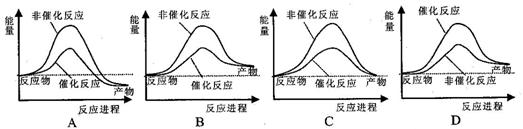
 2 CO2 (g) +S (g) ΔH=" +8.0" kJ/mol的反应来减少污染,使用新型催化剂加快反应。下列有关该反应过程的能量变化示意图正确的是
2 CO2 (g) +S (g) ΔH=" +8.0" kJ/mol的反应来减少污染,使用新型催化剂加快反应。下列有关该反应过程的能量变化示意图正确的是