题目内容
2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ·mol-1。请回答下列问题:

(1)图中A、C分别表示 、 ,E的大小对该反应的反应热 (填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点 (填“升高”还是“降低”),△H (填“变大”、“变小”或“不变”),理由是 。
(2)图中△H= KJ·mol-1。

(1)图中A、C分别表示 、 ,E的大小对该反应的反应热 (填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点 (填“升高”还是“降低”),△H (填“变大”、“变小”或“不变”),理由是 。
(2)图中△H= KJ·mol-1。
(1)反应物总能量;生成物总能量;无;降低;不变;因为催化剂可以降低反应的活化能,但不能改变反应物的总能量和生成物的总能量之差,即不改变反应热 (2)-198
试题分析:(1)根据反应过程可知,图中A、C分别表示反应物总能量和生成物总能量;E表示反应的活化能,不会影响该反应的反应热。由于催化剂可以降低反应的活化能,但不能改变反应物的总能量和生成物的总能量之差,即不改变反应热,因此△H不变。
(2)由于1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ·mol-1,所以热化学方程式2SO2(g)+O2(g)=2SO3(g)的反应热△H=-99kJ/mol×2=-198kJ/mol。

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目


 2HI(g)中H2的转化率随压强的变化
2HI(g)中H2的转化率随压强的变化 2AB3(g)化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是
2AB3(g)化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是
 >
> ,则正反应一定是放热反应
,则正反应一定是放热反应 的转化率大小为:b>a>c
的转化率大小为:b>a>c >
>
 不变时达到平衡,
不变时达到平衡,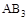 的物质的量大小为:c>b>a
的物质的量大小为:c>b>a

 2SO3(g);ΔH<0 正、逆反应的平衡常数K随温度的变化
2SO3(g);ΔH<0 正、逆反应的平衡常数K随温度的变化 是放热反应,说明CaO的能量大于
是放热反应,说明CaO的能量大于 的能量
的能量 晶体与氯化铵晶体反应不需要加热就能发生,说明该反应是放热反应
晶体与氯化铵晶体反应不需要加热就能发生,说明该反应是放热反应