题目内容
【题目】含氮的化合物广泛存在于自然界,是一类非常重要的化合物。回答下列问题:
(1)在一定条件下:2N2(g)+6H2O(g)=4NH3(g)+3O2(g)。己知该反应的相关的化学键键能数据如下:
化学键 | N≡N | H-O | N-H | O=O |
E/(kJ/mol) | 946 | 463 | 391 | 496 |
则该反应的△H=________kJ/mol.
(2)在恒容密闭容器中充入2molNO2与1molO2发生反应如下:4NO2(g)+O2(g)![]() 2N2O5(g)
2N2O5(g)
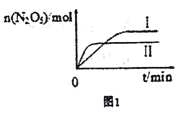
①已知在不同温度下测得N2O5的物质的量随时间的变化如图1所示。“高温下,该反应能逆向自发进行,原因是___________________________。
②下列有关该反应的说法正确的是________。
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
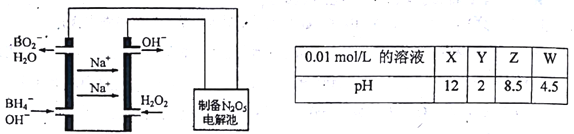
(3)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图。则砌氢化钠燃料电池的负极反应式为___________。
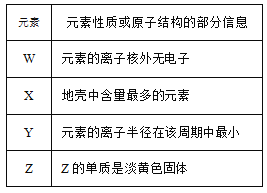
(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。上表是常温下浓度均为0.01mol/L的X、Y、Z、W溶液的pH。将X、Y、Z各1mol同时溶于水中得到混合溶液,则混合溶液中各离子的浓度由大到小的顺序为________________。
(5)氮的氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
I:2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
II:2NO(g)+Cl2(g)![]() 2ClNO(g) K2
2ClNO(g) K2
①4NO(g)+2NaCl(s) ![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=_____(用K1、K2表示);
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=_____(用K1、K2表示);
②在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2,10min时反应II达到平衡。测得10min内v(ClNO)=7.5×10-3mol/(L·min),则平衡时NO的转化率α1=_____;其他条件不变,反应II在恒压条件下进行,平衡时NO的转化率α2___α1 (填“>”“<”或span>“=”)。
【答案】 +1268 逆反应方向的△S>0 BD BH4-+8OH--8e-=BO2-+6H2O c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+) K12/K2 75% >
【解析】试题分析:(1)反应物的总键能-生成物的总键能=焓变。(2)先拐先平温度高,所以TⅡ>TⅠ;温度越高,生成物的量越少,说明升温平衡逆向移动,正反应放热。
(2)①根据熵变分析。
②A.扩大容器体积,浓度均减小;
B.恒温恒容,再充入2molNO2和1molO2,相当于加压,平衡正向移动;
C.根据ρ=![]() 分析;
分析;
D.根据正反应放热,升高温度平衡逆向移动分析;
(3)根据工作原理如图,硼氢化钠在负极放电生成BO2-;根据0.01mol/Ld的X、Y、Z、W的PH,X、Y、Z、W分别是NaOH、 HNO3、NaNO2、NH4NO3;NaNO2是强碱弱酸盐,水解呈碱性。
① Ⅰ:2NO2(g)+ NaCl(s)![]() NaNO3(s)+ ClNO(g) K1
NaNO3(s)+ ClNO(g) K1
Ⅱ:2NO(g)+ Cl2(g)![]() 2ClNO(g) K2
2ClNO(g) K2
化学方程式(Ⅰ×2-Ⅱ)得4NO2(g)+ 2NaCl(s)![]() 2NaNO3(s)+ 2NO(g)+Cl2(g);
2NaNO3(s)+ 2NO(g)+Cl2(g);
②根据![]() 分析
分析
解析:(1)根据反应物的总键能-生成物的总键能=焓变,反应2N2(g)+6H2O(g)=4NH3(g)+3O2(g) ΔH=946×2+463×12-391×12-496×3=+1268 kJ/mol;
(2)
①根据图示,先拐先平温度高,所以TⅡ>TⅠ;温度越高,生成物的量越少,说明升温平衡逆向移动,△H<0,化学反应易向着熵变增大的方向进行4NO2(g)+O2(g) ![]() 2N2O5(g)生成物气体分子数减少,正反应△S<0,逆反应△S>0,所以逆向自发进行。
2N2O5(g)生成物气体分子数减少,正反应△S<0,逆反应△S>0,所以逆向自发进行。
②A.扩大容器体积,平衡向逆反应方向移动,但浓度都减小,混合气体颜色变浅,故A错误;
B.恒温恒容,再充入2molNO2和1molO2,相当于加压,再次达到平衡时NO2转化率增大,故B正确;
C.恒温恒容,根据ρ=![]() ,容器内的密度为常量,密度不再改变,不一定达到平衡状态,故C错误;
,容器内的密度为常量,密度不再改变,不一定达到平衡状态,故C错误;
D.正反应放热,升高温度平衡逆向移动,平衡常数减小,若该反应的平衡常数增大,则一定是降低了温度,故D正确。
(3)根据工作原理如图,硼氢化钠在负极失电子生成BO2-,分解反应为BH4-+8OH--8e-=BO2-+6H2O;将NaOH、 HNO3、NaNO2各1mol同时溶于水中得到NaNO3、NaNO2混合溶液,NaNO2是强碱弱酸盐,水解呈碱性,混合溶液中各离子的浓度由大到小的顺序为c(Na+)>c(NO3-)>c(NO2-)>c(OH-)>c(H+);①化学方程式(Ⅰ×2-Ⅱ)得4NO2(g)+ 2NaCl(s)![]() 2NaNO3(s)+ 2NO(g)+Cl2(g),所以①平衡常数K= K12/K2;
2NaNO3(s)+ 2NO(g)+Cl2(g),所以①平衡常数K= K12/K2;
②10min内v(ClNO)=7.5×10-3mol/(L·min),所以生成ClNO的浓度为0.075mol/L,
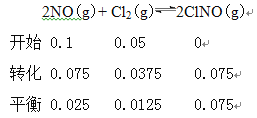
则平衡时NO的转化率α1=0.075÷0.1=75%;正反应物质的量减小,其他条件不变,反应Ⅱ在恒压条件下进行,相当于加压,平衡时NO的转化率增大所以α>α1。

【题目】硫代硫酸钠溶液与稀硫酸反应的化学方程式为:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,可以通过出现浑浊的快慢来判断反应的快慢程度,下列各组实验中最先出现浑浊的是( )
实验 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | ||
V/mL | c/(mol·L-1) | V/mL | c/(mol·L-1) | ||
A | 25 | 5 | 0.1 | 20 | 0.1 |
B | 25 | 5 | 0.2 | 10 | 0.2 |
C | 35 | 5 | 0.1 | 20 | 0.1 |
D | 35 | 5 | 0.2 | 10 | 0.2 |
A. A B. B C. C D. D