题目内容
【题目】已知常温下,Ksp[Mg(OH)2]=1.8×10-11, Ksp[Fe(OH)3]=4.0×10-38。
(1)常温常压下,氢气的燃烧热为285.8 kJ·mol-1。则氢气燃烧的热化学方程式为__________
(2)用离子方程式表示重铬酸钾在溶液中存在的平衡:__________
(3)将浓度均为0.1 mol/L的硫酸铝溶液与小苏打溶液混合,反应的离子方程式为__________
(4)将浓度均为0.1 mol/L的硫代硫酸钠溶液与稀硫酸混合,反应的离子方程式为__________
(5)向Mg(OH) 2悬浊液中滴加2滴0.1 mol/L FeCl3溶液,反应的离子方程式为__________
【答案】(1)2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol
(2)Cr2O72-+H2O![]() 2CrO42-+2H+
2CrO42-+2H+
(3)Al3++3HCO3-=Al(OH)3↓+3CO2↑
(4)S2O32-+2H+=S↓+SO2↑+H2O
(5)Mg(OH)2+Fe3+=Fe(OH)3+Mg2+
【解析】
试题分析:(1)常温常压下,1molH2完全燃烧生成液态水释放出285.8KJ的能量,则表示H2燃烧热的化学方程式为:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol;
(2)重铬酸根离子发生水解生成CrO42-,离子方程式为Cr2O72-+H2O![]() 2CrO42-+2H+;
2CrO42-+2H+;
(3)硫酸铝溶液与碳酸氢钠溶液混合,相互促进水解生成沉淀和气体,则反应的离子方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(4)发生氧化还原反应生成S、二氧化硫和硫酸钠、水,离子反应为S2O32-+2H+=S↓+SO2↑+H2O;
(5)在溶液中溶解度小的沉淀能转化为溶解度更小,由于Fe(OH)3的溶解度比Mg(OH)2的小,所以Mg(OH)2浊液中滴加0.1mol/L FeCl3溶液,白色的Mg(OH)2沉淀会转化为红褐色的Fe(OH)3沉淀,发生反应的离子方程式为Mg(OH)2+Fe3+=Fe(OH)3+Mg2+。

【题目】向容积为2L的密闭容器中充入一定量的H2O和CO,维持700℃发生反应:CO(g) + H2O(g)![]() CO2(g) + H2(g),反应过程中测定的部分数据见下表(表中t1<t2):
CO2(g) + H2(g),反应过程中测定的部分数据见下表(表中t1<t2):
反应时间/min | n(CO)/mol | H2O/ mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是
A. 反应在t1 min内的平均速率为v(H2)=0.40/t1 mol·L-1·min-1
B. 其他条件不变,起始时容器中充入0.60molCO和1.20 molH2O,达平衡时,n(CO2)=0.40 mol
C. 保持其他条件不变,向平衡体系中再通入0.20 molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小
D. 若温度升至800℃,上述反应的平衡常数为0.64,则正反应为吸热反应
【题目】含氮的化合物广泛存在于自然界,是一类非常重要的化合物。回答下列问题:
(1)在一定条件下:2N2(g)+6H2O(g)=4NH3(g)+3O2(g)。己知该反应的相关的化学键键能数据如下:
化学键 | N≡N | H-O | N-H | O=O |
E/(kJ/mol) | 946 | 463 | 391 | 496 |
则该反应的△H=________kJ/mol.
(2)在恒容密闭容器中充入2molNO2与1molO2发生反应如下:4NO2(g)+O2(g)![]() 2N2O5(g)
2N2O5(g)
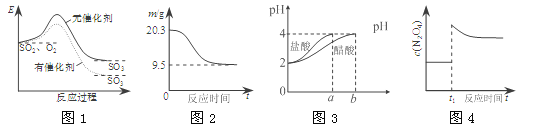
①已知在不同温度下测得N2O5的物质的量随时间的变化如图1所示。“高温下,该反应能逆向自发进行,原因是___________________________。
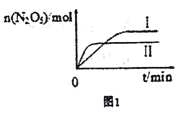
②下列有关该反应的说法正确的是________。
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图。则砌氢化钠燃料电池的负极反应式为___________。
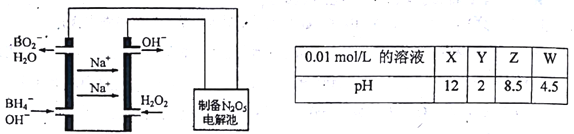
(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。上表是常温下浓度均为0.01mol/L的X、Y、Z、W溶液的pH。将X、Y、Z各1mol同时溶于水中得到混合溶液,则混合溶液中各离子的浓度由大到小的顺序为________________。
(5)氮的氧化物与悬浮在大气中的海盐粒子相互作用时,涉及如下反应:
I:2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
II:2NO(g)+Cl2(g)![]() 2ClNO(g) K2
2ClNO(g) K2
①4NO(g)+2NaCl(s) ![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=_____(用K1、K2表示);
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=_____(用K1、K2表示);
②在恒温条件下,向2L恒容密闭容器中加入0.2molNO和0.1molCl2,10min时反应II达到平衡。测得10min内v(ClNO)=7.5×10-3mol/(L·min),则平衡时NO的转化率α1=_____;其他条件不变,反应II在恒压条件下进行,平衡时NO的转化率α2___α1 (填“>”“<”或span>“=”)。