题目内容
【题目】短周期元素X、Y、Z、W核电荷数依次增大,X、Z同主族,Z、W同周期,四种元素的原子序数之和为37,在周期表中X是原子半径最小的元素,Y的最外层电子数是内层电子数的3倍。
(1)W在周期表中的位置是第 周期第 族。
(2)X与Y 能形成具有18个电子的化合物,此化合物的电子式为 。
(3)X、Y、Z三种元素组成的化合物中存在 (填“化学键”名称)。
(4)Z单质在W单质中燃烧火焰的颜色是 ;Z单质在空气燃烧生成的物质中,共价键的类型为 ;Y、Z、W形成的某种化合物类型是 化合物(填“共价”或“离子”)。
(5)X和Y形成的化合物沸点 (填“高”或“低”)于X和W形成的化合物沸点。
(6)W单质的水溶液滴入KBr溶液中的现象是 ;Z、W两种元素的最高价氧化物对应水化物溶液之间反应的离子方程式为 。
【答案】(1)三,ⅦA ;(2)![]() 或
或![]() ;(3)离子键、共价键;(4)黄色的火焰,非极性共价键, 离子;(5)高;(6)溶液由无色变橙红色,H++OH-=H2O。
;(3)离子键、共价键;(4)黄色的火焰,非极性共价键, 离子;(5)高;(6)溶液由无色变橙红色,H++OH-=H2O。
【解析】试题分析:(1)X的原子半径是周期表最小的元素,X为H,Y的最外层电子数是内层电子数的3倍,说明Y位于第二周期,即Y为O,X、Z同主族,且四种元素核电荷数 依次增大,则Z为Na,四种元素的原子序数之和为37,W:Cl,Cl位于第三周期第VIIA族;(2)X与Y能形成具有18电子的化合物,此物质为H2O2,其结构式为:H-O-O-H,电子式为:![]() 或
或![]() ;(3)三种元素组成的化合物为NaOH,属于离子化合物,含有的化学键为离子键、(极性)共价键;(4)Na元素的焰色反应为黄色,在氯气中燃烧火焰为黄色,Na在点燃的情况下生成Na2O2,其电子式为:
;(3)三种元素组成的化合物为NaOH,属于离子化合物,含有的化学键为离子键、(极性)共价键;(4)Na元素的焰色反应为黄色,在氯气中燃烧火焰为黄色,Na在点燃的情况下生成Na2O2,其电子式为:![]() ,共价键为非极性共价键,组成的化合物是氯的含氧酸盐,属于离子化合物;(5)X和Y组成的化合物为H2O,常温下为液态,X和W组成化合物为HCl,常温下为气体,因此填“高”;(6)利用氧化性强的制取氧化性弱的,Cl2+2Br-=2Cl-+Br2,溶液由无色变为橙红色,Z的最高价氧化物对应水化物为NaOH,W的最高价氧化物对应水化物为HClO4,都属于强电解质,其离子反应式为H++OH-=H2O。
,共价键为非极性共价键,组成的化合物是氯的含氧酸盐,属于离子化合物;(5)X和Y组成的化合物为H2O,常温下为液态,X和W组成化合物为HCl,常温下为气体,因此填“高”;(6)利用氧化性强的制取氧化性弱的,Cl2+2Br-=2Cl-+Br2,溶液由无色变为橙红色,Z的最高价氧化物对应水化物为NaOH,W的最高价氧化物对应水化物为HClO4,都属于强电解质,其离子反应式为H++OH-=H2O。

 名校课堂系列答案
名校课堂系列答案【题目】(Ⅰ)俄美科学家联合小组宣布合成出114号元素(Fl)的一种同位素,该原子的质量数是289,试回答下列问题:
(1)该元素在周期表中位于第___________周期,___________族,属于金属元素还是非金属元素? ___________。
(2)该原子核内中子数为___________;
(3)如果该元素存在最高价氧化物对应的水化物,请写出其化学式___________;
(Ⅱ)下表为元素周期表的部分,列出了10种元素在元素周期表中的位置,试回答下列问题:
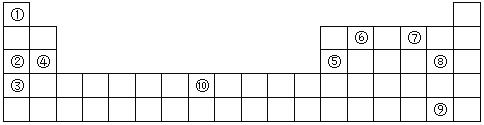
(1)②③④三种元素最高价氧化物的水化物碱性由强到弱的顺序是___________(填化学式)。
(2)10种元素中,原子半径最小的是___________(填序号)。
(3)元素⑦的氢化物与⑧的单质反应的离子方程式为___________;
(4)元素②和⑤的最高价氧化物的水化物相互反应的化学方程式为___________;
(5)元素⑩的原子序数为___________,其单质与⑦的氢化物高温下反应的化学方程式为___________;
(6)单质⑨易溶于⑥与⑧形成的化合物中,所得溶液颜色为___________色。
(Ⅲ)判断以下叙述正确的是___________
部分短周期元素的原子半径及主要化合价
元素代号 | L | M | Q | R | T |
原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
A.L2+、R2-的核外电子数相等
B.单质与稀盐酸反应的速率L<Q
C.M与T形成的化合物一定具有两性
D.氢化物的沸点为HnT>HnR
E.T与R形成的TR2、TR3均为共价化合物
F. Q与M的单质均能与盐酸、NaOH溶液反应放出氢气