题目内容
【题目】下列说法正确的是
A.任何化学反应都伴随着能量的变化
B.H2O(g)―→H2O(l)该过程放出大量的热,所以该过程是化学变化
C.化学反应中能量的变化一定都表现为热量的变化
D.氢氧化钡晶体和氯化铵晶体的反应属于放热反应
【答案】A
【解析】
试题分析:A、化学反应的实质是旧键断裂,新键形成,断裂旧键要吸收能量,形成新键要放出能量,所以任何化学反应都伴随着能量变化,A正确;B、气态水转化为液态水是物理变化,B错误;C、化学能可以转化为热能、电能、光能等,则化学反应中的能量变化不一定都表现为热量变化,C错误;D、氢氧化钡晶体和氯化铵晶体的反应属于吸热反应,D错误,答案选A。

【题目】(Ⅰ)俄美科学家联合小组宣布合成出114号元素(Fl)的一种同位素,该原子的质量数是289,试回答下列问题:
(1)该元素在周期表中位于第___________周期,___________族,属于金属元素还是非金属元素? ___________。
(2)该原子核内中子数为___________;
(3)如果该元素存在最高价氧化物对应的水化物,请写出其化学式___________;
(Ⅱ)下表为元素周期表的部分,列出了10种元素在元素周期表中的位置,试回答下列问题:
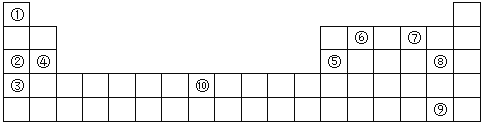
(1)②③④三种元素最高价氧化物的水化物碱性由强到弱的顺序是___________(填化学式)。
(2)10种元素中,原子半径最小的是___________(填序号)。
(3)元素⑦的氢化物与⑧的单质反应的离子方程式为___________;
(4)元素②和⑤的最高价氧化物的水化物相互反应的化学方程式为___________;
(5)元素⑩的原子序数为___________,其单质与⑦的氢化物高温下反应的化学方程式为___________;
(6)单质⑨易溶于⑥与⑧形成的化合物中,所得溶液颜色为___________色。
(Ⅲ)判断以下叙述正确的是___________
部分短周期元素的原子半径及主要化合价
元素代号 | L | M | Q | R | T |
原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
A.L2+、R2-的核外电子数相等
B.单质与稀盐酸反应的速率L<Q
C.M与T形成的化合物一定具有两性
D.氢化物的沸点为HnT>HnR
E.T与R形成的TR2、TR3均为共价化合物
F. Q与M的单质均能与盐酸、NaOH溶液反应放出氢气