题目内容
(14分)无机物A是一种固体,熔点178℃,30℃以下为浅黄色。经测定A(相对分子质量为184)含两种元素,原子个数比为1:1。隔绝空气迅速加热A将发生爆炸,爆炸后残留物B呈淡黄色。该淡黄色物质在空气中加热会燃烧并产生刺激性气味。在一定条件下,6.18g液体SCl2和2.72g气体C恰好完全反应生成A和单质B及6.42克化合物D。加热D发现无任何物质存在,把D溶于水测得溶液的pH小于7。已知气体C在标准状况下的密度为0.76g·L-1。
(1)A的化学式为 ,C的电子式 。
(2)写出SCl2和气体C反应的化学方程式 。
(3)1molSCl2能与2mol乙烯发生加成反应生成一种化学毒气芥子气,写出发生反应的化学方程式 。
(4)亚硝酸钠和D固体在加热条件下 (填“可能”或“不能”)发生反应,判断理由是 。
(5)请设计检验物质D的实验方案 。
(1)N4S4,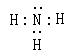 ;(2)6SCl2+16NH3= N4S4+2S+12NH4Cl;
;(2)6SCl2+16NH3= N4S4+2S+12NH4Cl;
(3)SCl2+2CH2=CH2→Cl—CH2—CH2—S—CH2—CH2—Cl ;
(4) 可能; NaNO2中的氮的化合价为+3价,NH4Cl中的氮的化合价为-3价,因而有可能发生氧化还原反应生成氮气 ;
(5)取少量D固体加水溶解,分成两份。其中一份与NaOH溶液混合加热,若产生使湿润的红色石蕊试纸变蓝的气体则证明有NH4+;另一份溶液中加入硝酸酸化的AgNO3溶液,若出现白色沉淀,则证明有Cl-离子。
解析试题分析:(1)隔绝空气迅速加热A将发生爆炸,爆炸后残留物单质B呈淡黄色。该淡黄色物质在空气中加热会燃烧并产生刺激性气味气体,则B是S单质。在标准状况下C的的密度为0.76g·L-1,则C的摩尔质量是0.76g/L×22.4L/mol=17g/mol。则C为NH3.其电子式为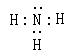 。n(SCl2)= 6.18g÷103g/mol=0.06ml;n(NH3)= 2.72g÷17g/mol=0.16mol。加热化合物D发现无任何物质存在,把D溶于水测得溶液的pH小于7。根据元素守恒可得D为NH4Cl。n(NH4Cl)= 6.42g÷53.5g/mol=0.12mol。所以在物质A中含有N:0.04mol,含有H:0.16×3-0.12×4=0mol。A含两种元素,原子个数比为1:1,因此另一种元素是S,设其化学式是(SN)n。因为相对分子质量为184,所以46n=184,因此n=4.A的化学式为N4S4。(2)因为n(NH3)= 0.16mol;n(NH4Cl)= 0.12mol。则A物质含有N原子0.04mol,所以A的物质的量为0.01mol.,产生的S单质的物质的量为0.06ml=0.04mol=0.02mol。根据生成的物质结合元素守恒可得SCl2和氨气反应的方程式为6SCl2+16NH3= N4S4+2S+12NH4Cl;(3)根据题意及物质间的物质的量关系可得方程式为SCl2+2CH2=CH2→Cl—CH2—CH2—S—CH2—CH2—Cl ;(4)由于在亚硝酸钠中N的化合价为+3价,在NH4Cl中N的化合价为-3价,所以根据氧化还原反应的规律,二者在加热条件下能够发生反应。产生中间价态的物质氮气。(5)离子的检验方法是取少量D固体加水溶解,分成两份。其中一份与NaOH溶液混合加热,若产生使湿润的红色石蕊试纸变蓝的气体则证明有NH4+;另一份溶液中加入硝酸酸化的AgNO3溶液,若出现白色沉淀,则证明有Cl-离子。
。n(SCl2)= 6.18g÷103g/mol=0.06ml;n(NH3)= 2.72g÷17g/mol=0.16mol。加热化合物D发现无任何物质存在,把D溶于水测得溶液的pH小于7。根据元素守恒可得D为NH4Cl。n(NH4Cl)= 6.42g÷53.5g/mol=0.12mol。所以在物质A中含有N:0.04mol,含有H:0.16×3-0.12×4=0mol。A含两种元素,原子个数比为1:1,因此另一种元素是S,设其化学式是(SN)n。因为相对分子质量为184,所以46n=184,因此n=4.A的化学式为N4S4。(2)因为n(NH3)= 0.16mol;n(NH4Cl)= 0.12mol。则A物质含有N原子0.04mol,所以A的物质的量为0.01mol.,产生的S单质的物质的量为0.06ml=0.04mol=0.02mol。根据生成的物质结合元素守恒可得SCl2和氨气反应的方程式为6SCl2+16NH3= N4S4+2S+12NH4Cl;(3)根据题意及物质间的物质的量关系可得方程式为SCl2+2CH2=CH2→Cl—CH2—CH2—S—CH2—CH2—Cl ;(4)由于在亚硝酸钠中N的化合价为+3价,在NH4Cl中N的化合价为-3价,所以根据氧化还原反应的规律,二者在加热条件下能够发生反应。产生中间价态的物质氮气。(5)离子的检验方法是取少量D固体加水溶解,分成两份。其中一份与NaOH溶液混合加热,若产生使湿润的红色石蕊试纸变蓝的气体则证明有NH4+;另一份溶液中加入硝酸酸化的AgNO3溶液,若出现白色沉淀,则证明有Cl-离子。
考点:考查物质的分子式、电子式和反应的方程式的书写、离子的检验、化学式的推断的知识。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案设NA表示阿伏加德罗常数的值,下列说法不正确的是
| A.T0C时,1 L pH=6的纯水中,含有的OH-数目为1×10-6NA |
| B.12.0 g NaHSO4固体中含有的阳离子数目为0.1 NA |
| C.50 g 98%的浓硫酸中,所含的氧原子数目为2NA |
| D.1 molNa2O2与足量CO2充分反应转移的电子数目为NA |
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
| | 溶质的物质的量浓度/mol·L-1 | 溶液的密度/g·cm-3 |
| 硫酸 | c1 | ρ1 |
| 氨水 | c2 | ρ2 |
(1)表中硫酸的质量分数为________(不写单位,用含c1、ρ1的代数式表示)。
(2)物质的量浓度为c1 mol·L-1的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为________mol·L-1。
(3)物质的量浓度为c2 mol·L-1的氨水与
 c2 mol·L-1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度________
c2 mol·L-1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度________ c2 mol·L-1(设混合后溶液的体积变化忽略不计)。
c2 mol·L-1(设混合后溶液的体积变化忽略不计)。 
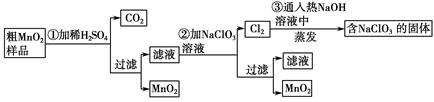
 +
+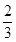 时,b= ,得到的CO和CO2的物质的量之比n(CO)∶n(CO2)= 。
时,b= ,得到的CO和CO2的物质的量之比n(CO)∶n(CO2)= 。