题目内容
将3.52 g CO2和SO2混合气体通入一定量的NaOH溶液中,气体全部与NaOH反应生成盐,将反应后的溶液减压低温蒸干后得到不含结晶水的固体,固体的质量可能为
| A.8.48 g | B.7.48 g | C.5.72 g | D.5.22g |
AB
解析试题分析:CO2与NaOH反应可能生成Na2CO3或NaHCO3,SO2与NaOH反应可能生成Na2SO3或NaHSO3,根据极值法,固体质量的最小值为全部为SO2,生成NaHSO3的情况,m(最小)=3.51g÷64g/mol×104g/mol=5.72g,原气体为混合气体,所以固体质量一定大于5.72g,原题并没有指明恰好完全反应,NaOH有可能过量,造成固体质量增大,因此只要大于5.72g都有可能,故A项、B项正确。
考点:本题考查物质的化学反应及相关计算。

练习册系列答案
相关题目
如图,抽走玻璃片使氨气与氯化氢充分反应。下列有关描述合理的是(NA表示阿伏加德罗常数)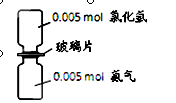
| A.反应前气体反应物的总体积为0.224 L |
| B.生成物的分子个数为0.005 NA |
| C.产物中的N-H键个数为0.02NA |
| D.加水溶解后所得溶液中NH4+数目为0.005 NA |
下列有关化学用语使用正确的是
A.CH4分子的球棍模型: |
| B.乙烯的结构简式:CH2CH2 |
C.S的结构示意图: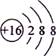 |
D.原子核内有l8个中子的氯原子: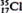 |
下列有关甲醛的化学用语表达错误的是
| A.结构简式:HCHO | B.最简式:CH2O |
C.比例模型: | D.电子式: |
有4.8g CuO、Fe2O3混合物跟足量CO充分反应后固体减少1.28g,反应后全部气体用0.6mol/L Ba(OH)2溶液100mL吸收。下列有关叙述中正确的是
| A.原混合物中CuO与Fe2O3物质的量的比为l:l |
| B.原混合物中CuO与Fe2O3的质量比为2:1 |
| C.吸收CO2后的溶液中一定有Ba(HCO3)2 |
| D.吸收CO2后的溶液中生成白色沉淀的质量为11.82 g |
取不同质量的镁铝合金分别与25 mL同浓度的稀硝酸反应,测量合金的质量与产生气体的体积(标准状况),列表如下:
| 实验编号 | 合金质量(mg) | 气体体积(mL) |
| 1 | 144 | 112 |
| 2 | 288 | 224 |
| 3 | 864 | 560 |
若第3个实验后向反应容器内加入足量的1.0 mol/L NaOH(aq)充分反应,使固体质量不再发生变化。硝酸的浓度及至少需要NaOH(aq)的体积是
| 硝酸的浓度 | NaOH(aq)的体积 | ||
| A. | B. | C. | D. |
| 4.0 mol/L | 1.0 mol/L | 75 mL | 99 mL |
在下列条件下,两种气体的分子数一定相等的是
| A.同温度,同体积的N2和O2 | B.同质量,不同密度的N2和CO |
| C.同压强,同体积的H2和CH4? | D.同体积,同密度的CO2和N2 |
微粒有多种表示方式,下列各组不同表示方式一定代表同种微粒的是
| A.C3H6、CH2=CHCH3 | B.-OH、 |
C. 、 、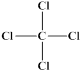 | D. 、1s22s22p63s23p6 、1s22s22p63s23p6 |
用NA表示阿伏加德罗常数,下列结论能够成立的是
| A.2L0.1mol/L的NaCO3溶液中含有CO32-的个数是0.2NA |
| B.1 molFe与足量稀硝酸完全反应转移的电子数为2NA |
| C.0.2mol/LCuSO4溶液加水稀释至体积增加l倍,其浓度变为0.1mol/L |
| D.常温下pH=5的H2SO3水溶液中c(H+):c(SO32-)=2:1 |