题目内容
取不同质量的镁铝合金分别与25 mL同浓度的稀硝酸反应,测量合金的质量与产生气体的体积(标准状况),列表如下:
| 实验编号 | 合金质量(mg) | 气体体积(mL) |
| 1 | 144 | 112 |
| 2 | 288 | 224 |
| 3 | 864 | 560 |
若第3个实验后向反应容器内加入足量的1.0 mol/L NaOH(aq)充分反应,使固体质量不再发生变化。硝酸的浓度及至少需要NaOH(aq)的体积是
| 硝酸的浓度 | NaOH(aq)的体积 | ||
| A. | B. | C. | D. |
| 4.0 mol/L | 1.0 mol/L | 75 mL | 99 mL |
AD
解析试题分析:分析1、2组数据可知,金属的质量之比等于对应NO的体积之比,说明1、2组金属完全反应,第3组金属若完全反应,可得NO体积为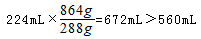 ,故第3组金属有剩余,硝酸完全反应。第3个实验后向反应容器内加入足量的1.0mol/L NaOH(aq)充分反应,使固体质量不再发生变化,使氢氧化铝恰好转化为NaAlO2,需要氢氧化钠溶液的体积最小,此时溶液中溶质为NaNO3、NaAlO2,第3组生成的NO的物质的量为
,故第3组金属有剩余,硝酸完全反应。第3个实验后向反应容器内加入足量的1.0mol/L NaOH(aq)充分反应,使固体质量不再发生变化,使氢氧化铝恰好转化为NaAlO2,需要氢氧化钠溶液的体积最小,此时溶液中溶质为NaNO3、NaAlO2,第3组生成的NO的物质的量为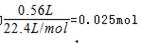 ,由反应
,由反应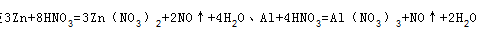 可知,起氧化剂作用的硝酸为总的硝酸的1 4 ,故25mL硝酸溶液中
可知,起氧化剂作用的硝酸为总的硝酸的1 4 ,故25mL硝酸溶液中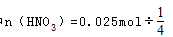 =0.1mol,原硝酸溶液的浓度为
=0.1mol,原硝酸溶液的浓度为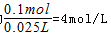 。起酸性作用的硝酸的物质的量为0.1mol-0.025mol=0.075mol,
。起酸性作用的硝酸的物质的量为0.1mol-0.025mol=0.075mol,
令144mg合金中Mg、Al的物质的量分别为xmol、ymol,由二者质量与转移电子数目守恒有: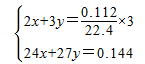 解得x=0.0015,y=0.004,故864mg合金中Al的物质的量
解得x=0.0015,y=0.004,故864mg合金中Al的物质的量  ,根据钠离子守恒可知n(NaOH)=n(NaNO3)+n(NaAlO2)=0.075mol+0.024mol=0.099mol,故需要氢氧化钠溶液的最小体积为
,根据钠离子守恒可知n(NaOH)=n(NaNO3)+n(NaAlO2)=0.075mol+0.024mol=0.099mol,故需要氢氧化钠溶液的最小体积为 ,故选AD。
,故选AD。
考点:本题考查混合物的有关计算,过程复杂、计算量较大,题目难度较大,注意利用守恒思想进行的解答。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案研究发现,硝酸越稀,还原产物中氮元素的化合价越低。某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出。在反应结束后的溶液中,逐滴加入5 mol/L的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。下列说法正确的是
| A.溶液中结合OH-能力最强的离子是NH4+ |
| B.D点时溶液中存在:c(NH4+)+c(H+)=c(OH-)+c(NO3-) |
| C.合金中n(Fe) :n(Al)=1 :3 |
| D.C的值为7 |
研究发现,硝酸越稀,还原产物中氮元素的化合价越低。某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出。在反应结束后的溶液中,逐滴加入4mol/LNaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。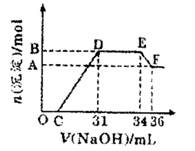
分析上述图形,下列说法不正确的是
| A.OC段离子反应方程式:H+十OH-=H2O |
| B.溶液中结合OH-能力最强的离子是H+,最弱的离子是Al3+ |
| C.溶液中n(NH4+)=0.012mol |
| D.欲测定F点沉淀的质量,实验步骤是:过滤、洗涤、干燥、称量 |
镁铝碱式盐对工业污水中的铬有良好吸附性。取该碱式盐0.7525g,滴加1.0mol/L盐酸,当加盐酸21.25mL时开始产生CO2气体,加入盐酸至22.50mL时恰好反应完全,向该溶液中加入过量氢氧化钠溶液,过滤,沉淀物进行干燥后重0.4350g。则该碱式盐的化学式是
| A.Al2Mg6(OH)16CO3?4H2O | B.Al4Mg12(OH)34CO3?8H2O |
| C.Al2Mg4(OH)16CO3?4H2O | D.Al3Mg6(OH)34CO3?8H2O |
将3.52 g CO2和SO2混合气体通入一定量的NaOH溶液中,气体全部与NaOH反应生成盐,将反应后的溶液减压低温蒸干后得到不含结晶水的固体,固体的质量可能为
| A.8.48 g | B.7.48 g | C.5.72 g | D.5.22g |
常温常压下NO2气体通入足量的水中,充分反应后,溶液的质量增加了54g。反应中有关物质的物理量正确的是(NA表示阿伏加德罗常数)
| | 一氧化氮 | 硝酸 | 转移的电子 |
| A. | 1mol | | 2NA |
| B. | 11.2L | 1mol | |
| C. | | 63g | 2mol |
| D. | | 1mol | NA |
NA表示阿伏加德罗常数,有关NA的正确说法是
| A.1mol D318O+中含有的中子数为10NA |
| B.标准状况下,22.4L水中含O-H键数为2NA |
| C.某温度时1L pH=6的纯水所含OH-离子数为1.0×10-6NA |
| D.7.8 g Na2S和Na2O2的混合物中含有的阴离子数大于0.1 NA |
下列化学用语正确的是
A.重水的分子式: |
B.Mg2+的结构示意图: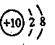 |
| C.乙酸的分子式:CH3COOH |
D.HCIO的电子式: |
用 NA表示阿伏加德罗常数的值。下列说法正确的是
| A.7.8 g Na2O2中含有的阴离子数目为0.2 NA |
| B.3.2 g O2和O3的混合气中含有的氧原子数目为0.2 NA |
| C.1 L 0.1 mol/L的 Al2(SO4)3溶液中,Al3+的数目为0.2 NA |
| D.过氧化氢分解制得标准状况下1.12 L O2,转移电子数目为 0.2 NA |