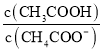题目内容
【题目】能量是一个世界性的话题,如何充分利用能量、开发新能源,为人类服务是广大科技工作者不懈努力的目标。
(1)如图所示,组成一个原电池:
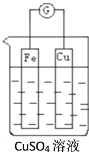
Cu电极是___(填“正”或“负”)极,其电极反应式为___;电子由___极流出。
(2)利用(1)图中的电极和电解液,在增加电源后可以实现电能转化为化学能,Fe接入电源负极,Cu接入电源正极,电解过程电极质量增加的是___(填“Fe”或“Cu”),Fe的腐蚀速度比正常在空气中的腐蚀速度___(填“快”或“慢”),溶液中c(Cu2+)___(填“增大”、“减小”或“不变”)。
(3)利用氢气与氧气的燃烧反应2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1,作为燃料电池的反应原理,可以提高能量的利用率,填充H2的电极是____(填“正”或“负”)极;当有11.2L(折算成标准状况下的体积)H2反应,会放出___kJ热量;如果2H2(g)+O2(g)=2H2O(g) ΔH=-a kJ·mol-1,则a___571.6(填“>”、“<”或“=”)
【答案】正 Cu2++2e-=Cu Fe Fe 慢 不变 负 142.9 <
【解析】
(1)在原电池中,相对活泼的金属电极为负极,另一电极为正极。则Fe为负极,Cu为正极;负极材料(Fe)失电子生成阳离子(Fe2+)进入溶液,电极反应为Fe-2e-=Fe2+;铜电极为正极,发生反应Cu2++2e-=Cu,电子由负极(Fe)沿导线流入正极(Cu);
(2)Fe接入电源负极,为电解池的阴极,发生反应为:Cu2++2e-=Cu;Cu接入电源正极,为电解池的阳极,发生反应为:Cu-2e-=Cu2+;由此可知,Fe电极质量增加,Fe做阴极,得到保护,溶液中n(Cu2+)增减相平,由此可得出溶液中c(Cu2+)的变化;
(3)从反应方程式看,H2失电子,填充H2的电极是负极;当有标况下11.2L H2,即0.5mol H2发生反应时,可依据方程式计算放出的热量;当由H2O(l)转化为H2O(g)时,需要吸收热量,从而使a值减小。
(1)在原电池中,相对活泼的金属电极为负极,另一电极为正极。则Fe为负极,Cu为正极。负极材料(Fe)失电子生成阳离子(Fe2+)进入溶液,电极反应为Fe-2e-=Fe2+;铜电极为正极,发生反应Cu2++2e-=Cu,电子由负极(Fe)沿导线流入正极(Cu);
(2)Fe接入电源负极,为电解池的阴极,发生反应为:Cu2++2e-=Cu;Cu接入电源正极,为电解池的阳极,发生反应为:Cu-2e-=Cu2+。由此可知,Fe电极质量增加,Fe做阴极,得到保护,Fe的腐蚀速度比正常在空气中的腐蚀速度慢;溶液中n(Cu2+)增减相平,由此可得出溶液中c(Cu2+)不变;
(3)从反应方程式看,H2失电子,填充H2的电极是负极;当有标况下11.2L H2,即0.5mol H2发生反应时,可依据方程式2H2(g)+O2(g)=2H2O(l) ΔH= -571.6kJ·mol-1,计算放出的热量为![]() kJ;由H2O(l)转化为H2O(g)时,需要吸收热量,从而使a值减小,即a<571.6。
kJ;由H2O(l)转化为H2O(g)时,需要吸收热量,从而使a值减小,即a<571.6。

 阅读快车系列答案
阅读快车系列答案【题目】Ⅰ.在实验室利用下列装置,可制备某些气体并验证其化学性质。

完成下列表格:
序号 | 气体 | 装置连接顺序(填字母) | 制备反应的化学方程式 |
(1) | 乙烯 | B→D→E | ___ |
(2) | 乙炔 | ___ | ___ |
(3)D装置中氢氧化钠溶液的作用___。
Ⅱ.工业上用乙烯和氯气为原料,经下列各步合成聚氯乙烯(PVC):
乙烯![]() 甲
甲![]() 乙
乙![]() PVC
PVC
(4)甲的结构简式是___;
(5)反应③的化学方程式是__。
(6)下列说法正确的是___。
A.乙烯可以作为植物生长调节剂
B.PVC不能使酸性高锰酸钾溶液褪色
C.PVC中的官能团是碳碳双键和氯原子
【题目】下列实验结论与实验现象相符合的一组是
选项 | 实验 | 现象 | 结论 |
A | 向某盐溶液中加入浓NaOH溶液,加热 | 产生的气体能使湿润的红色石蕊试纸变蓝 | 原溶液中含有 |
B | 把SO2通入紫色的酸性高锰酸钾溶液中 | 溶液紫色褪去 | SO2具有漂白性 |
C | 向蔗糖中滴加浓硫酸 | 蔗糖变黑 | 浓硫酸具有吸水性 |
D | 向盛有Cu片的试管中加入稀H2SO4,无明显现象,再加入NaNO3固体 | Cu片逐渐溶解,产生气 泡,溶液变蓝 | NaNO3是催化剂,可增大Cu与稀H2SO4反应的化学反应速率 |
A.AB.BC.CD.D
【题目】分别向等体积的不含O2、含有O2的0.1mol·L1BaCl2溶液中通入SO2,探究体系中物质间的相互作用,实验记录如下。(已知:pH越小,溶液酸性越强)
pH变化 |
|
溶液中是否产生沉淀 | 不含O2的BaCl2溶液中没有白色沉淀,含有O2的BaCl2溶液中产生白色沉淀。 |
下列说法不正确的是
A.a所示溶液的pH降低的原因:SO2与H2O反应生成H2SO3,溶液的c(H+)增大
B.b所示溶液中发生反应:2Ba2++O2+2SO2+2H2O=2BaSO4↓+4H+
C.b比a所示溶液的pH小的原因:Ba2++SO2+H2O=BaSO3↓+2H+
D.SO2通入不含O2的BaCl2溶液后,再通入NH3,产生BaSO3沉淀