题目内容
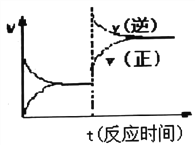
【题目】现将浓度相等、体积分别为V1、V2的CH3COOH、NaOH溶液混合,测量混合液温度,结果如图(已知:V1+V2=50 mL)。下列叙述错误的是( )
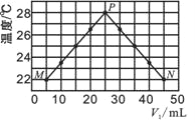
A. 实验的环境温度低于 22℃
B. P点的混合溶液的pH=7
C. 混合溶液的导电能力:M > N
D. 若将CH3COOH改为HCl,P点温度高于 28℃
【答案】B
【解析】试题分析:首先读懂图表,题设图表揭示了中和反应过程中酸、碱溶液体积变化与反应溶液温度变化的关系,了解下列各点:CH3COOH溶液和NaOH溶液混合后溶液温度上升,说明酸碱反应是放热的;温度上升的大小随酸、碱相对体积的变化而变化,说明反应放热的大小与发生反应的酸、碱的数量有密切相关;图线的起始点表示5 mL CH3COOH溶液和45 mL NaOH溶液混合后温度是22℃;当25 mL CH3COOH溶液和25 mL NaOH溶液混合时,反应液温度达到最高值28℃。由此,可以断定该实验的环境温度低于22℃;25 mL CH3COOH 溶液和25 mL NaOH溶液混合可恰好完全反应,放热最多,生成强碱弱酸盐,溶液的PH>7,M点醋酸完全反应,NaOH有剩余,N点NaOH完全反应,CH3COOH 有剩余,由于醋酸是弱酸,部分电离,NaOH是强碱,全部电离,所以混合溶液的导电能力:M > N,醋酸是弱酸,部分电离,在反应的过程中,不断吸收能量,所以若将CH3COOH改为HCl,P点温度高于28℃,可见,选项A、C、D正确,B错误;选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目