题目内容
某铁的氧化物,用7.0 mol/L的盐酸100 mL在一定条件下恰好完全溶解,所得溶液中再通入0.56L标况下的Cl2时,刚好使溶液中的Fe2+全部转化为Fe3+,则该氧化物中Fe2+与Fe3+的物质的量之比为
| A.1:4 | B.2:1 | C.4:1 | D.3:4 |
A
试题分析:设该氧化物中Fe2+与Fe3+的物质的量分别是x和y。标准状况下0.56L氯气的物质的量=0.56L÷22.4L/mol=0.025mol,在反应中得到0.025mol×2=0.050mol电子。则根据电子的得失守恒可知,亚铁离子的物质的量是0.05mol。盐酸的物质的量=0.1L×7.0mol/L=0.7mol,则根据氯原子守恒可知最终溶液中氯化铁的物质的量=
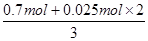 =0.25mol。则根据铁原子守恒可知该氧化物中铁离子的物质的量=0.25mol-0.05mol=0.2mol,所以该氧化物中Fe2+与Fe3+的物质的量之比为0.05:0.2=1:4,答案选A。
=0.25mol。则根据铁原子守恒可知该氧化物中铁离子的物质的量=0.25mol-0.05mol=0.2mol,所以该氧化物中Fe2+与Fe3+的物质的量之比为0.05:0.2=1:4,答案选A。
练习册系列答案
相关题目
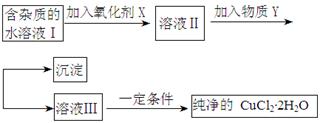
 样品含有少量
样品含有少量 杂质。现要测定其中
杂质。现要测定其中 的质量分数,实验按以下步骤进行:
的质量分数,实验按以下步骤进行:

 溶液18.00mL。该样品中
溶液18.00mL。该样品中