题目内容
铁铜单质及其化合物的应用范围很广。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按照如图步骤进行提纯:
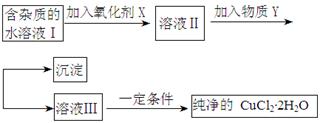
已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
请回答下列问题:
(1)加入氧化剂的目的是
(2)下列最适合作氧化剂X的是
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(3)加入的物质Y是
(4)如果不用物质Y而直接用可溶性碱溶液能不能达到目的? (填“能”或者“不能”)。若不能,试解释原因 (若填“能”,此空不用回答)
(5)最后能不能直接蒸发得到CuCl2·2H2O? (填“能”或者“不能”)。若不能,应该如何操作才能得到CuCl2·2H2O (若填“能”,此空不用回答)
(6)若向溶液Ⅱ中加入碳酸钙,产生的现象是
(7)若向溶液Ⅱ中加入镁粉,产生的气体是 ,试解释原因
(8)FeCl3溶液具有净水作用的原因是

已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH见下表:
| | Fe3+ | Fe2+ | Cu2+ |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物沉淀完全时的pH | 3.2 | 9.0 | 6.7 |
请回答下列问题:
(1)加入氧化剂的目的是
(2)下列最适合作氧化剂X的是
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(3)加入的物质Y是
(4)如果不用物质Y而直接用可溶性碱溶液能不能达到目的? (填“能”或者“不能”)。若不能,试解释原因 (若填“能”,此空不用回答)
(5)最后能不能直接蒸发得到CuCl2·2H2O? (填“能”或者“不能”)。若不能,应该如何操作才能得到CuCl2·2H2O (若填“能”,此空不用回答)
(6)若向溶液Ⅱ中加入碳酸钙,产生的现象是
(7)若向溶液Ⅱ中加入镁粉,产生的气体是 ,试解释原因
(8)FeCl3溶液具有净水作用的原因是
(1)将Fe2+氧化为Fe3+,便于生成沉淀与Cu2+分离(1分) (2)C (1分) (3)CuO(也可以是氢氧化铜、碳酸铜或者碱式碳酸铜) (1分) (4)不能(1分) ,加碱使Fe3+沉淀的同时也能使Cu2+沉淀(1分) (5)不能(1分) 应该在HCl气体氛围中进行蒸发结晶(2分) (6)碳酸钙溶解,产生气泡和红褐色沉淀(2分) (7)氢气(1分) 镁粉与氯化铁、氯化铜水解得到的氢离子作用,产生氢气(1分) (8)铁离子水解成氢氧化铁胶体,吸附水中的悬浮颗粒物,加速沉降。起到净水作用(2分)
试题分析:(1)加入氧化剂,将Fe2+氧化为Fe3+,易除去,除杂时,不能引入新的杂质(2)加入过氧化氢能使亚铁离子氧化为铁离子,且不引入新杂质。故选C。(3)加入的物质Y可调节,使Fe3+全部沉淀,同时不引进新杂质,所以可以用Cu(OH)2、CuCO3、CuO、Cu2(OH)2CO3等。(5)不能,由于铜离子易水解,应在HCl气体氛围中进行蒸发结晶。(6)溶液Ⅱ中加入碳酸钙,由于溶液中含有H+,碳酸钙分解,形成二氧化碳气体和水,同时铁离子水解,形成氢氧化铁红褐色沉淀。(7)向溶液Ⅱ中加入镁粉,镁粉与氯化铁、氯化铜水解得到的氢离子作用,产生氢气。(8)铁离子水解成氢氧化铁胶体,吸附水中的悬浮颗粒物,加速沉降。起到净水作用。

练习册系列答案
相关题目
 2Cu+SO2反应制取粗铜,当有32gCu2S消耗时,电子转移数目是 。
2Cu+SO2反应制取粗铜,当有32gCu2S消耗时,电子转移数目是 。