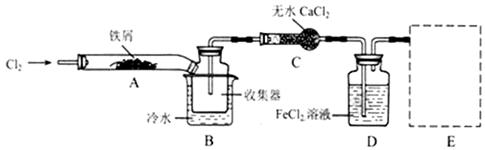
题目内容
由于Fe(OH)2极易被氧化,所以实验室里很难用亚铁盐溶液与烧碱反应制的白色纯净的Fe(OH)2沉淀。应用如图所示的电解实验可制得白色纯净Fe(OH)2沉淀,两电极的材料分别为石墨和铁。下列说法正确的是( )
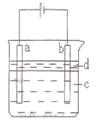

| A.a电极发生的电极反应:4OH--4e-=O2↑+2H2O |
| B.为了在较短时间内看到白色沉淀,可适当加大电压 |
| C.c可以是氯化钠溶液,d可以是苯 |
| D.为了在较短时间内看到白色沉淀,可以剧烈地搅拌溶液 |
BC
试题分析:A.a连接电源正极,为电解池的阳极,发生Fe-2e-=Fe2+,故A错误;B.短时间内看到白色沉淀,适当增大电源电压、适当缩小两电极间距离可增大反应的速率,故B正确;C.苯的密度水的小,不溶于水,可隔绝空气,防止氢氧化亚铁被氧化,C正确D.剧烈地搅拌溶液 ,能促使氢氧化亚铁被氧化,故D错误.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
 2Cu + SO2
2Cu + SO2