题目内容
MnCO3可用作电讯器材元件材料,还可用作瓷釉、颜料及制造锰盐的原料。实验室模拟以MnO2为原料生产MnCO3的工艺流程如下: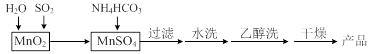
已知:MnCO3难溶于水和乙醇,受热易分解。
⑴ 实验室中过滤操作所用到的玻璃仪器有漏斗、烧杯、 。
⑵①检验水洗是否合格的方法是 。
②水洗结束后,用乙醇洗涤的目的是 。
⑶ MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示。则300℃时,剩余固体中n(Mn)∶n(O)为 ;图中点D对应固体的成分为 (填化学式)。
⑴玻璃棒(1分)
⑵①取最后一次洗涤滤出液少许于一支试管中,向其中滴加盐酸酸化的氯化钡溶液,若无明显现象,说明水洗合格(或其他合理答案) (2分)
②乙醇易挥发,便于低温干燥,防止MnCO3受热分解(1分)
⑶1∶2 (3分) Mn3O4和MnO(或其他合理表达) (3分)
解析试题分析:
⑶设MnCO3的物质的量为1 mol,即质量为115 g
①A点剩余固体质量为115 g×75.65%="87" g
减少的质量为115 g-87 g="28" g
可知MnCO3失去的组成为CO
故剩余固体的成分为MnO2
②C点剩余固体质量为115 g×61.74%="71" g
据锰元素守恒知m(Mn)="55" g,则m(O )1="71" g-55 g="16" g
则n(Mn)∶n(O)=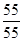 ∶
∶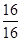 =1∶1
=1∶1
故剩余固体的成分为MnO
同理,B点剩余固体质量为115 g×66.38%="76.337" g
因m(Mn)="55" g,则m(O )2="76.337" g-55 g="21.337" g
则n(Mn)∶n(O)=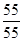 ∶
∶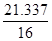 =3∶4
=3∶4
故剩余固体的成分为Mn3O4
因D点介于B、C之间,故D点对应固体的成分为Mn3O4与MnO的混合物。

 阅读快车系列答案
阅读快车系列答案已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题: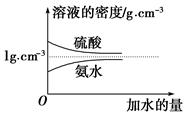
| | 溶质的物质的量浓度/mol·L-1 | 溶液的密度/g·cm-3 |
| 硫酸 | c1 | ρ1 |
| 氨水 | c2 | ρ2 |
(1)表中硫酸的质量分数为________(不写单位,用含c1、ρ1的代数式表示)。
(2)物质的量浓度为c1 mol·L-1的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为________mol·L-1。
(3)物质的量浓度为c2 mol·L-1的氨水与
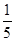 c2 mol·L-1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度________
c2 mol·L-1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度________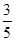 c2 mol·L-1(设混合后溶液的体积变化忽略不计)。
c2 mol·L-1(设混合后溶液的体积变化忽略不计)。 铜及其合金是人类最早使用的金属材料。
(1)金属铜采取下列哪种方式堆积( )
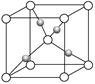
(2)在1个Cu2O晶胞中(结构如上图所示),Cu原子配位数为__________。
(3)科学家通过X射线推测胆矾中既含有配位键,又含有氢键,其结构示意图可简单表示如下: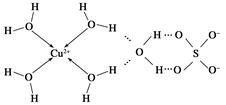
①胆矾的化学式用配合物的形式表示为____________。
②胆矾中SO42—的空间构型为________,H2O中O原子的杂化类型为________。
③某兴趣小组称取2.500 g胆矾晶体,逐渐升温使其失水,并准确测定不同温度下剩余固体的质量,得到如图所示的实验结果示意图。下列说法正确的是( )
| A.晶体从常温升到105 ℃的过程中只有氢键断裂 |
| B.胆矾晶体中形成配位键的4个水分子同时失去 |
| C.120 ℃时,剩余固体的化学式是CuSO4·H2O |
| D.按胆矾晶体失水时所克服的作用力大小不同,晶体中的水分子可以分为3种 |
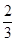 时,b= ,得到的CO和CO2的物质的量之比n(CO)∶n(CO2)= 。
时,b= ,得到的CO和CO2的物质的量之比n(CO)∶n(CO2)= 。