题目内容
【题目】以磷石膏(只要成分CaSO4,杂质SiO2、Al2O3等)为原料可制备轻质CaCO3。
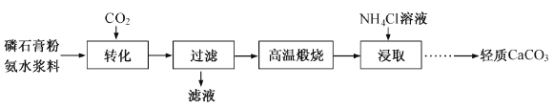
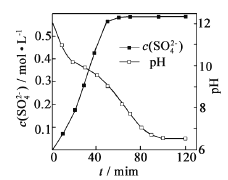
(1)匀速向浆料中通入CO2,浆料清液的pH和c(SO42-)随时间变化见由右图。清液pH>11时CaSO4转化的离子方程式_____________;能提高其转化速率的措施有____(填序号)
A.搅拌浆料 | B.加热浆料至100℃ |
C.增大氨水浓度 | D.减小CO2通入速率 |
(2)当清液pH接近6.5时,过滤并洗涤固体。滤液中物质的量浓度最大的两种阴离子为______和________(填化学式);检验洗涤是否完全的方法是_________。
(3)在敞口容器中,用NH4Cl溶液浸取高温煅烧的固体,随着浸取液温度上升,溶液中c(Ca2+)增大的原因___________。
【答案】CaSO4+2NH3·H2O+CO2=CaCO3+2NH4+或CaSO4+CO32-=CaCO3+SO42- AC SO42- HCO3- 取少量最后一次的洗涤过滤液于试管中,向其中滴加盐酸酸化的BaCl2溶液,若不产生白色沉淀,则表明已洗涤完全 浸取液温度上升,溶液中c(H+)增大,促进固体中Ca2+浸出。
【解析】
(1)向磷石膏粉、氨水浆料中通入CO2,CO2与NH3·H2O 发生反应:CO2+2NH3·H2O===2NH4++CO32-+H2O,CO32-浓度增大,促进了CaSO4沉淀的转化:CaSO4+CO32-===CaCO3+SO42-,总反应的离子方程式为CaSO4+2NH3·H2O+CO2===CaCO3+2 NH4++SO42-+H2O。A.搅拌浆料,可增大反应物的接触面积,加快化学反应速率,A正确;B.加热浆料,由于NH3的挥发,导致NH3·H2O浓度降低,不利于CO32-的生成,降低了CaSO4的转化速率,B错误;C.增大氨水浓度,有利于提高CO32-的浓度,从而提高CaSO4的转化速率,C正确;D. 减小CO2通入速率,不利于CO32-的生成,从而降低CaSO4的转化速率,D错误,答案选AC。
(2)由图象可知,pH=6.5时,溶液中的c(Ca2+)已经很小,此时通入的CO2与溶液中浓度较低的氨水反应生成NH4HCO3,故溶液中物质的量浓度最大的两种阴离子为SO42-和HCO3-。过滤得到的CaCO3沉淀上会附着SO42-、NH4+、HCO3-等杂质离子。检验洗涤是否完全时,可取少量最后一次从过滤器中流出的洗涤液于试管中,向其中滴加盐酸酸化的BaCl2溶液,检验是否存在SO42-即可。若不产生白色沉淀,表明沉淀已洗涤完全。
(3)NH4Cl溶液中存在水解平衡:NH4++H2O![]() NH3·H2O+H+,温度升高,上述水解平衡右移,c(H+)增大,导致部分CaCO3溶解,促进固体中Ca2+浸出,浓度增大。
NH3·H2O+H+,温度升高,上述水解平衡右移,c(H+)增大,导致部分CaCO3溶解,促进固体中Ca2+浸出,浓度增大。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案